Lungenkarzinom
Definition
Zu den Lungenkarzinomen gehören alle maligne epitheliale Tumoren des Lungenparenchyms einschließlich der neuroendeokrinen Karzinome, jedoch nicht die malgnen Mesotheliome der Pleura, Sarkome der Lunge, das pulmonale Blastom oder Metastasen. Man unterscheidet zwei Haupttypen des Lungenkarzinoms: Zum einen das kleinzellige Bronchialkarzinom SCLC, das ca. 20% aller Bronchialkarzinome ausmacht7 und das nichtkleinzellige Bronchialkarzinom NSCLC1. Letzteres macht in etwa 80% aller Bronchialkarzinome aus139.
Nach der aktuellen Klassifikation der WHO zählen zu den NSCLC folgende histologische Typen: Plattenepithelkarzinome (ca. 30-40%14 aller BC; Tumorverdopplungszeit ca. 300 Tage)13, Adenokarzinome (ca. 45%14 aller BC; Tumorverdopplungszeit ca. 180 Tage)13 und großzellige Karzinome9 (ca. 10%)13.
Kleinzellige Karzinome zählen zu den neuroendokrinen Tumoren. Zu ihnen zählen weiterhin die typischen und atypischen Karzinoide und die großzelligen neuroendokrine Tumoren9. Das SCLC ist charakterisiert durch ein schnelles Wachstum und eine frühe Metastasierung7. Die Tumorverdopplungszeit beträgt nur 10-50 Tage13.Epidemiologie
Lungentumoren zählen in der Europäischen Union (EU) zu den dritthäufigsten maligen Neubildungen3. Sie machen insg. ca. 25% aller Karzinome aus13. Von allen Karzinomerkrankungen versterben weltweit die meisten Patienten am Bronchialkarzinom13. Mittlerweile sind allerdings rückläufige Todesraten zu verzeichnen4. Die regionale Inzidenz variiert dabei mit der Prävalenz der Raucher1. Die Inzidenz von Lungentumoren beträgt in der EU bei 52/100 000 pro Jahr13, die Mortalität bei 48.7/100000 pro Jahr5. In Deutschland muss jährlich mit etwa 45000 Neuerkrankungen gerechnet werden11. Etwa 90% der Tumoren der Lunge sind bei den Männern (und 80% bei Frauen) auf das Rauchen zurückzuführen5. Die Therapie und Prognose hängen wesentlich von der TNM-Ausbreitung ab3. Ca. 20-30% der Patienten präsentieren sich mit einem T1-Tumor3.
- Plattenepithelkarzinom: Das Plattenepithelkarzinom ist neben dem Adenokarzinom der häufigste Lungentumor in den westlichen Industrienationen, und ist am stärksten mit dem Rauchen assoziiert8. Männer sind deutlich häufiger betroffen als Frauen mit einem Verhältnis zwischen 6,6-15 zu 18. Studien aus den USA weisen jedoch darauf hin, dass die Plattenepithelkarzinome als auch die kleinzelligen und großzelligen Tumoren der Lunge bei Männern rückläufig sind8. Grund ist unter anderem ein Rückgang des Zigarettenkonsums8.
- Adenokarzinom: Das Adenokarzinom tritt am häufigsten in Japan und einigen anderen asiatischen Ländern auf, zeigt aber mittlerweile auch in den westlichen Industrienationen eine steigende Inzidenz8 und ist vieler Orts häufiger als das Plattenepithelkarzinom. Männer sind etwa doppelt so häufig betroffen wie Frauen, das Durchschnittsalter zum Diagnosezeitpunkt ist etwas niedriger als bei den Plattenepithelkarzinomen8.
- Kleinzelliges Bronchialkarzinom: Das kleinzellige Bronchialkarzinom macht ca. 20% aller Lungentumoren aus7. Männer sind bis zu 4mal häufiger betroffen als Frauen8. Es besteht eine starke Assoziation mit dem Konsum von Tabak8. Diese Tumorentität ist dafür bekannt, dass es früh zu regionalen Lymphknoten- und Organmetastasen kommt8.
Ätiologie
- Rauchen: Hauptrisikofaktor für die Entstehung von Bronchialkarzinome ist nach wie vor der Konsum von Tabak1413. Dabei bestimmt vor allem die Dauer und das Ausmaß des Zigarettenkonsums das Lungenkrebsrisiko13. Entscheidend sind hier die pack years (=Zahl der täglich gerauchten Packungen x Raucherjahre)13. Dabei spielt es keine Rolle, ob Zigarren und Pfeifen oder Light-Zigaretten konsumiert werden1. Bei der Kombination von Tabak mit Exposition gegenüber beruflichen Karzinogenen potenziert sich das Lungenkrebsrisiko13.
- Passivrauchen: Ca. 1,6% aller Bronchialkarzinome sind auf das Passivrauchen zurückzuführen1. Ergebnisse von Metaanalysen zeigten ein relatives Risiko von 1,14 bis 5,2 von Nichtrauchern, die mit Rauchern zusammenlebten1. Dabei spielen vor allem die Dauer und die Intensität der Aussetzung eine Rolle4.
- Alkohol: Es besteht ein leicht erhöhtes Risiko für Patienten an Lungenkrebs zu erkranken, wenn mehr als 30g/d Alkohol konsumiert wird1.
- Umweltnoxen: Eine Langfristige negative Auswirkungen kann die kumulierte Exposition gegenüber Umweltnoxen wie Luftverschmutzung und Emissionen die reich an polyzyklischen aromatischen Kohlenwasserstoff-Verbindungen sind, haben1. Die Anzahl der Fälle an Lungenkrebs, die auf städtische Luftverschmutzung zurückzuführen ist, wird in Europa wird mit ca. 11% angegeben1.
- Toxine am Arbeitsplatz: Es ist bekannt, dass bei beruflichen Tätigkeiten mit bestimmten karzinogenen Stoffen das Risiko, an Lungenkrebs zu erkranken, erhöht ist1. Kristalline Kieselsäure, Haloether13, Chrysotilasbest, Radon4, Arsen413, Chrom413, Nickel413, Vinylchlorid4, ionisierende Strahlung4[], Quarzstaub[], PAH13, und Silikate sind nur ein kleiner Teil an Substanzen, die mit einem erhöhten Krebsrisiko einhergehen1. Weiterhin zählen auch Arbeiter in Uranminen und Kernkraftwerken zu gefährdeten Personen1. Aber auch eine Asbestexposition gilt als Risikofaktor für die Entstehung eines Bronchialkarzioms413.
- Erkrankungen der Lunge: Bereits bestehende nicht maligne Lungenerkrankungen, wie
die COPD, die idiopathische pulmonale Fibrose und die Tuberkulose sind mit einem erhöhten Lungenkrebsrisiko assoziiert4. Auch Lungennarben können zum „Narbenkarzinom“ und „Kavernenkarzinom“ führen13. - Genetische Disposition: Es besteht ein 2-3fach erhöhtes Risiko für Personen, bei denen ein Elternteil an einem Bronchialkarzinom erkrankt ist13. Bestimmte Genvarianten auf Chromosom 14 erhöhen dabei das Risiko bei Rauchern an einem Bronchialkarzinom zu erkranken13.
Molekularpathologie von Lungenkarzinomen
Genetische Veränderungen umfassen Chromosomenanomalien (Verlust der Heterozygotie) als auch Punktmutationen der dominanten Onko- und Tumorsuppressorgene8. Der Verlust der Funktion einiger Tumorsuppressorgene wird durch DNA-Methylierung vermittelt8.
Unter den vier wichtigsten histologischen Subtypen des Lungenkarzinoms, zeigt das kleinzellige Karzinom am häufigsten allelische Verluste8. Betroffen sind vor allem die Chromosomen 3p und 22q als auch Amplifikation der Onkogene aus der myc-Familie wie N-myc, L-myc und c-myc8. Diese Amplifikationen sind ein wichtiger prognostischer Faktor in SCLC8.
Allel-Verluste der Chromosomen 3p, 13q und 17p bei NSCLC gehen mit einer besseren Prognose einher als Verluste von 2q, 9p, 18q, 22q und spielen eine wichtige Rolle in der Tumorprogression8. Vor allem in Plattenepithelkarzinomen ist die Reihenfolge der histologischen Veränderungen über Dysplasie zum Carcinoma in situ und von dort zum invasiven Karzinom gut etabliert814. Eine Deletion von 3p kann hier nicht nur in Karzinomen, sondern auch schon in dysplastischen und hyperplastischen Läsionen festgestellt werden8.
In frühen Stadien von Adenokarzinomen finden sich bereits Deletionen von 5q, 9p, 11q und 13q, im Verlauf der malignen Progression kommen 3p, 17p, 18q und 22q hinzu8. Genetische Veränderungen einschließlich Punktmutationen der dominante Onkogene wie das ras-Gen und Punktmutationen von Tumorsuppressorgenen wie p53, das Retinoblastom (RB)- und das p16-Gen sind gut untersucht8. Die Punktmutation des p53-Gens ist ein wichtiger prognostischer Faktor des Adenokarzinoms8.
Die Molekularpathologie als auch die Immunhistochemie auf molekularer Basis sind insofern von Bedeutung, da sie neben der Diagnose der einzelnen Tumorentitäten, auch den Malignitätsgrad, das metastatische Potential und die Vorhersage des therapeutischen Ansprechens ermöglichen8.
Klassifikation der Bronchialkarzinome4, eine Übersicht
| Klasse | Prävalenz (%) | Subtypen |
|---|---|---|
| Adenokarzinome | 40 | Lepidische, Azinäre, papilläre, mikropapilläre und solide Tumore mit Schleimbildung als auch gemischtzellige Tumoren |
| Plattenepithelkarzinome | 25 | - |
| Großzellige Tumoren | 10 | Großzellige neuroendokrine Tumoren, basaloide, lymphoepitheliale und Großzellige Tumoren mit rhabdoiden Phänotyp |
| SCLC | 20 | entweder als reine SCLC oder gemischt mit NSCLC auftretend |
| Adenosquämose Tumoren | <5 | - |
| Karzinoide | <5 | - |
| Tumoren von den Bronchialdrüsen ausgehend | <5 | - |
Bei einem Patienten mit Lungenkrebs, ist die histologische Differenzierung zwischen
SCLC und NSCLC von größter Bedeutung, da beide Entitäten unterschiedlich radikal therapiert werden24. Nach geltender Diktion gilt ausschließlich die Histologie, nicht aber die Immunhistologie für die Einordnung von NSCLCs als Adeno- bzw. Plattenepithelkarzinom. Die Unterscheidung zwischen SCLC und NSCLC via Sputumzytologie, TTNA Zytologie, und Bronchoskopie (mit BAL , Bürstenabstrich und Zytologie) sind allesamt sehr zuverlässig2. Verschiedene Studien zeigen eine Genauigkeit in der Differenzierung von SCLC vs. NSCLC von 0,982.
Adenokarzinome Klassifikation (IASLC/ATS/ERS)
AIS / MIA müssen komplett aufgearbeitet werden.
Die bis dato publizierten Studien beziehen sich auf Tumoren ≤2 cm bzw. ≤3 cm, daher ist nicht bekannt wie sich Tumoren, die >3 cm sind und die entsprechenden histomorphologischen Charakteristika aufweisen, verhalten.
In der Biopsie ist die Unterscheidung zwischen AIS / MIA nicht möglich.
AAH, AIS und MIA bilden ein Kontinuum verwandter Läsionen. Da alle Läsionen (bei Fehlen von Multifokalität!) mit einem nahezu 100% krankheitsspezifischen Überleben verknüpft sind, ist die Einordnung nicht kritisch. Kritisch hingegen ist die Abgrenzung zu „invasiven“ Adenokarzinomen, daher müssen diese Läsionen in toto aufgearbeitet werden.
Muzinöse Läsionen sind in diesem Spektrum (in unserem Einsendegut) so gut wie nicht existent.
Adenokarzinome
Histologische Charakteristika der Adenokarzinome: Drüsen-/Schleimbildung (5 Muzin-positive Tumorzellen/HPF in 2 benachbarten HPF), häufig exzentrische Zellkerne. „Reine Typen“ sind selten (7,5%). Wenn sie anzutreffen sind, dann findet sich meist ein azinäres oder solides Wachstumsmuster. Der prädominante Anteil wird in der Diagnose angegeben.
Seltene Sonderformen
Die muzinösen Neoplasien wurden in toto umklassifiziert, muzinöse BAC sind nahezu abgeschafft. Klarzellige und siegelringzellige Adenokarzinome ebenfalls wurden abgeschafft.
Mit den enterischen Adenokarzinomen wurde eine neue „Entität“ geschaffen.
| Plattenepithelkarzinome | |
|---|---|
| Makroskopie | Mindestens 50% aller Plattenepithelkarzinome entstehen in den großen Bronchien (Haupt oder Segmentbronchus)48. Der Tumor zeigt sowohl endobronchiales als auch invasives Wachstum ins peribronchiale Weichgewebe, Lungenparenchym, und in die benachbarten Lymphknoten; eine Kompression der Pulmonalgefäße kann resultieren8. Bei großen Tumoren kommt es oft zu ausgedehnten Koagulationsnekrosen und in manchen Fällen auch zur Kavernenbildung814. Das endobronchiale Tumorwachstum führt oft zu sekundären Veränderungen in der distalen Lunge, wie Sektretretention, Bronchiektasen Atelektasen, Lipid- und Broncho- und Retentionspneumonien8. Plattenepithelkarzinome peripheren Ursprungs sind meist knotig konfiguriert mit gut definierten Zellgrenzen8. Sie lassen sich grob in die 2 folgenden Typen unterteilen: 1. Tumoren mit zentraler oder subpleuraler Fibrose und Anthrakose, mit bevorzugtem Wachstum in die Alveolarräume und 2. Tumoren ohne Narbenbildung, bei denen auf der Schnittfläche keine anthrakotischen Pigmente bzw. nur spärliche Mengen erkennbar sind8. |
| Histologie | Das pulmonale Plattenepithelkarzinom stellt laut WHO-Klassifikation einen malignen epithelialen Tumor mit zellulären Atypien14, Verhornungszeichen (wirbelartige und zwiebelschalenähnliche Hornperlen14 ) und/oder Nachweis von Interzellularbrücken dar, der sich vom Bronchialepithel ableitet8. Die Zellen haben meist eine polygonale Form und sind in einem faserigen Stroma eingebettet8. Sie sind die einzigen Lungentumoren, die sich über bronchiale Präneoplasien (Schleimhautdysplasien mit zellulären Atypien/Carcinoma in situ entlang der Bronchien) entwickeln und der Metastasierung vorausgehen8914. Die Tumoren zeigen damit unterschiedliche Differenzierungsgrade14. Plattenepithelkarzinome können papilläre, klarzellige, kleinzellige, und basaloide Wachstumsmuster aufzeigen8. Die papillären Tumoren gehen gehäuft mit einem endobronchialen, exophytischen Wachstum einher8. Die kleinzellige Variante kann von einem SCLC durch eine plattenepitheliale Komponente und die morphologischen Merkmale der kleinen Tumorzellen, die den nuklearen Eigenschaften eines NSCLC entsprechen, abgegrenzt werden8. Die basaloide Variante zeigt eine Palisadenbildung der Zellkerne am Rand der Tumorzellnester8. |
| Anmerkung | Die Metastasierung erfolgt in der Regel später im Krankheitsverlauf als bei den Adenokarzinomen4. |
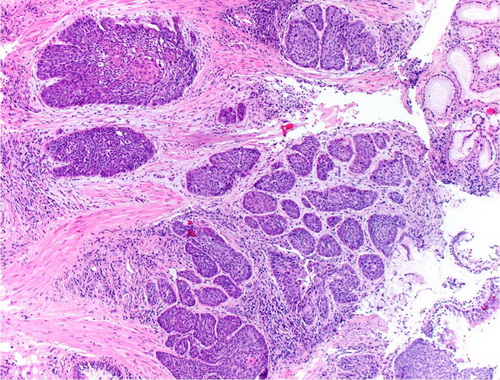
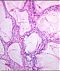
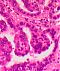
Abb. 550: Basaloides Plattenepithelkarzinom
| Großzelliges Karzinom | |
|---|---|
| Die Tumoren entstehen häufig in der Peripherie der Lunge, und können bei ausbleibender Therapie in die Brustwand einwachsen8. Sie bilden eine sphärische Struktur mit klar definierten Grenzen, und haben eine fleischig, homogene und sarkomatöse Schnittfläche8. Einige großzellige Karzinome ähneln schlecht differenzierten Adeno- oder Plattenepithelkarzinomen8. | |
| Histologie | Charakteristisch sind Nester von polygonalen Zellen mit großen Zellkernen, prominenten Nukeolen, nur mäßiggradiger Zytoplasmaentwicklung14 und wenig fibrovaskulären Stroma. Karzinome, die mit starker Muzinproduktion einhergehen, werden nach den WHO-Kriterien als Adenokarzinome klassifiziert, alle anderen als großzellige Tumoren. |
| Anmerkung | Diese Entität umfass alle undifferenzierten epitheliale Tumoren der Lunge, in denen eindeutig kleinzellige und plattenepitheliale Komponenten fehlen14. Großzellige Karzinome müssen von denen mit endokriner Differenzierung abgegrenzt werden. Weitere Varianten umfassen basaloide Karzinome, lymphoepitheliom-ähnliche Karzinome, klarzellige und großzellige Karzinome mit rhabdoidem Phänotyp, die alle jedoch selten sind814. |
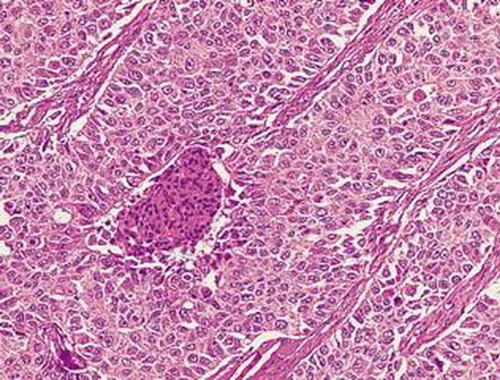
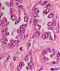
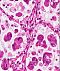
Abb. 551: Großzelliges Karzinom
Neuroendokrine Tumoren der Lunge
Die neuroendokrinen Tumoren der Lunge entstehen aus den Kulchitzky Zellen der Bronchialmukosa10. Sobald die Diagnose eines neuroendokrinen Tumors gefallen ist, ist es von besonderer Wichtigkeit diesen weiter zu klassifizieren910:
| Neurokrine Klassifizierung | Mitosen | Nekrosen | Histologie | Immunhistochemie | Lokalisation/Makroskopie |
|---|---|---|---|---|---|
| Typische Karzinoidtumoren/low grade neuroendokrine Karzinome | 0-1 pro 2 mm² | keine Nekrosen | solide Zellnester, Rosetten, Trabekelbildung | Chromogranin pos. | mind. 5mm großer11 zentral gelegener Tumor10 |
| Atypische Karzinoidtumoren/low grade neuroendokrine Karzinome | 2-10 mm² | Nekrosen | solide Zellnester, Rosetten, Trabekelbildung, erhöhte Zellpleomorphie10 | Chromogranin pos. | peripher gelegen10 |
| Großzellige neuroendokrine Tumoren | viele Mitosen (>30 mm²) | ausgedehnte nekrotische Areale | ähnliche Zellformation wie bei den Karzioidtumoren, daneben noch Pallisadenstellung der Tumorzellen11, polygonale , große Zellen mit großen Zellkernen(25-35μm), Nukleoli und feingranuliertem eosinophilen Zytoplasma10 | Chromogranin, Synaptophysin und andere neuroendokrine Marker ( NCAM = CD56) pos. in mehr als 25% der Fälle | meist peripher gelegen10 |
| Kleinzellige neuroendokrine Tumoren | viele Mitosen | organoides Wachstum, kleine (zwischen 5-8μm große14) runde, polygonale oder spindelförmige11 Zellen, die Haferkörner ähneln („oat cell carcinoma“)13, die Zellen wenig kohäsiv14, hyperchromatische Zellkerne8, wenig Zytoplasma, das Stroma ist zart und gefäßreich, charakteristisch sind Quetschartefakte14 selten findet sich eine Lymphozyteninfiltration8. | Chromogranin, Synaptophysin und TTF-1 positiv | 90-95% der Tumoren sind zentral (perihilär11 ) gelegen10, manschettenartige intrapulmonale Ausbreitung innerhalb der bronchialen Submukosa11. Periphere Tumoren zeigen ein solides knotiges Wachstum mit gut definierten Grenzen und einer fleischigen medullären Schnittfläche8. |
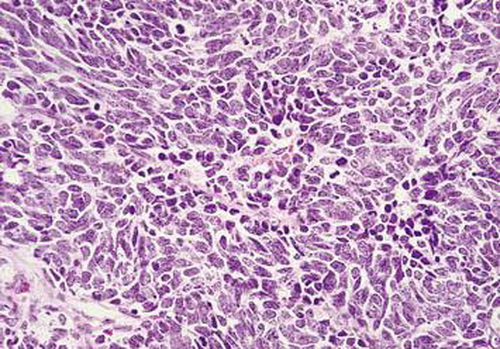
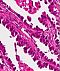
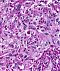
Abb. 552: SCLC, erkennbar sind locker verteilte kleine Tumorzellen mit wenig Zytoplasma.
Besonderheiten:
Bei neuroendokrinen Tumoren kann es zu Kalzifikationen kommen10. Weiterhin sind die Tumoren gut vaskularisiert10. Die kleinzelligen Tumoren sind sehr aggressiv und zeigen bei Diagnosestellung häufig schon ein fortgeschrittenes Stadium, gehen mit einer massiven mediastinalen Infiltration einher, setzen extrem früh extrathorakale Metastasen und führen zu einem paraneoplastischen Syndrom4.
Die großzelligen Tumoren sind zumeist schlechter differenziert und setzen früh Metastasen4.
Die aktuelle WHO-Klassifikation weist außerdem darauf hin, dass in 10-20% der Plattenepithelkarzinome und Adenokarzinome immunhistochemisch eine neuroendokrine Differenzierung nachzuweisen ist, ohne dass diese Tumoren eine „neuroendokrine Morphologie“ aufweisen11. Das kleinzellige Karzinom bildet häufig Amin- und Peptidhormone wie ACTH, ADH, Calcitonin und Serotonin und geht mit einem Cushing-Syndrom oder Schwartz-Bartter-Syndrom einher8.
Sonderformen von Bronchialkarzinomen
- Frühkarzinom des Bronchus: Hierbei handelt es sich um ein lokal infiltrierendes Karzinom, das noch auf die Bronchialwand beschränkt ist14. Es besteht keine Infiltration des Lungen- oder lymphatischen Gewebes14. Die Diagnose kann nur sicher am Resektat gestellt werden14.
- Okkultes Karzinom: Hierbei handelt es sich um einen positiven zytologischen Nachweis ohne Herdbefund in der Bildgebung, die eine rasche endoskopische Abklärung erfordert14.
- Mikrokarzinom: Diese Gruppe umfasst klinisch nicht aufgedeckte Primärtumoren der Lunge, die einen Durchmesser von 3-10m haben14. Histologisch handelt es sich dabei zumeist um kleinzellige Bronchialkarzinome14.
- Tumorlets: Tumorlets sind atypische Epithelproliferate im Bereich der bronchoalveolären Endstrecke. Sie finden sich häufig im fortgeschrittenen Stadium der Lungenfibrose, bei Asbestose und nach erfolgter Chemotherapie14.
- Pancoast-Syndrom: Ein Pancoast-Syndrom liegt dann vor, wenn ein peripherer maligner Lungentumor (überwiegend Adenokarzinome) über die Lungenspitze hinaus in umliegende Strukturen wie Nerven, Gefäße und Weichteile einbricht14. Bei Tumorinfiltration des Truncus sympathicus kann es zum Horner-Syndrom kommen14.
Immunhistochemie
Die Immunhistochemie spielt in der Diagnostik der Bronchialkarzinome eine wichtige Rolle9. Mit ihrer Hilfe ist eine diagnostische und prognostische Aussage möglich9. Zum Einsatz kommen folgende Marker9:
| Epitheliale Marker9 | Charakteristika |
|---|---|
| Zytokreratin AE1/AE3 | Marker für Adenokarzinome, Anfärbung des Zytoplasmas9 |
| CK7 | Marker für primäre pulmonale Adenokarzinome8, Anfärbung des Zytoplasmas9 |
| CK20 | Marker für den GI-Trakt, mit dessen Hilfe lassen sich primäre Bronchialkarzinome (CK20 neg.) von Lungenmetastasen mit Primarius aus dem GI-Trakt (CK20 pos.) unterscheiden89. Gleiches gilt für Thyreoglobulin (Ausschluss SD-Karzinom Metastasen), PSA (Ausschluss von Prostata-CA Metastasen) Estrogen und Progesteron (Ausschluss von Mamma-CA Metastasen) und CA125 (Ausschluss von Metastasen eines Ovarialtumors)9 |
| CK5/6 | Marker für Plattenepithelkarzinome9 |
| Zytokeratin 34ßE12/35ßH11 | Marker für Plattenepithelkarzinome9 |
| Surfactant Apoprotein | Dieser Marker findet sich hauptsächlich im Zytoplasma der Typ-II-Alveolarepithelzellen8. Es werden die folgenden vier Subtypen: SPA, SPB, SPC und SPD unterschieden8. Der monoklonale Antikörper PE-10 ist ein spezifischer Antikörper gegen SPA, und reagiert positiv mit Typ-II-Alveolarepithelzellen und Tumoren vom Clarazelltyp8. SPC hingegen reagiert nur spezifisch auf Typ-II-Alveolarepithelzellen, nicht aber in Clara-Zellen oder andere Epithelzellen der Lunge8. |
| LEU-7 (CD57) | LEU-7 ist bekannt für seine Reaktion mit natürlichen Killerzellen und findet als Marker für die (APUD)-Zellen Verwendung8. Sowohl gut bis mäßig differenzierte Adenokarzinome als auch SCLC zeigten eine positive Reaktion8. Plattenepithelkarzinome reagieren hingegen sehr selten positiv8. |
| CEA | CEA ist ein Glykoprotein in der Glykokalyx embryonaler endodermaler Zellen8. Es ist ein nützlicher Marker in Bezug auf die maligne Progression einzelner Tumoren8. Positive Reaktionen finden sich bei invasiven Bronchioloalveolarkarzinom vom Typ-II-Alveolarepithelzellen und / oder Clara-Zelltyp8. Eine erhöhte Färbeintensität korreliert mit einer Zunahme von Atypien8. |
| Neuroendokrine Marker9 | _. |
|---|---|
| Chromogranin A | Chromogranin A ist ein Strukturprotein der neuroendokrinen Granula in den Tumorzellen des kleinzelligen Karzinoms, in Karzinoiden und anderen Tumoren mit neuroendokriner Differenzierung8. Es färbt das Zytoplasma der Tumorzellen9 |
| Synaptophysin | Anfärbung des Zytoplasmas9 |
| TTF-1(Thyroid transcription factor-1) | TTF-1 ist ein Transkriptionsprotein, das von Schilddrüsen- und Lungenepithelien exprimiert wird8. Es färbt die Zellkerne an9. |
| p53 | Anfärbung der Zellkerne |
| CD56 | Dieser Antikörper detektiert fast alle Tumorzellen eines SCLC, aber auch großzellige neuroendokrine Tumoren8 |
| AADC | Eine positive Reaktion findet sich in Kulchitsky Zellen der Bronchien, in Karzinoiden, und in kleinzelligen Bronchialkarzinom8. |
| ZIP-codes are 5- or 9-digit codes |
| Mesenchymale Marker9 | _. |
|---|---|
| LCA(Leucocyte common antigene | Anfärbung des Zytoplasmas9 |
| SMA | Anfärbung des Zytoplasmas9 |
| Vimentin | Vimentin ist ein guter Marker zur Detektion von Mesotheliomen und bei Bronchialkarzinomen i.d.R. negativ8. In seltenen Fällen kann es von Adenokarzinomen und großzelligen Karzinomem exprimiert werden8. |
Weitere biologische Marker
- p53: Mutationen im p53 Gen (Tumorsuppressorgen) führen zum Verlust des p53 Proteins bzw. zu dessen Inaktivität9. Die mutierten Proteine zeigen ein längeres Überleben als der Wildtyp, und gehen mit höheren Konzentrationen in transformierten Zellen einher9. Solche Punktmutationen finden sich gehäuft in Bronchialkarzinomen und gehen mit einem schlechteren Überleben einher9. Es besteht eine Korrelation zur Exposition von Umweltgiften und dem Rauchen9.
- c-erB-1: Dies ist ein Proto-Onkogen, das an die Zellmembran gebunden für ein Wachstumsrezeptor ( EGFR ) kodiert9. Dieses Proto-Onkogen ist häufig in NSCLC überexprimiert, vor allem in Plattenepithelkarzinomen9.
- c-erB-2: Dieses Proto-Onkogen zählt zur c-erb-Familie, die für Thyrosinkinaserezeptoren kodieren9. Es ist bekannt als HER-2(Human epidermal growth factor receptor 2) und wird in den epithelialen Zellen des Respirationstraktes gebildet9. Dort spielt es eine wichtige Rolle im Wachstum und in der Differenzierung der Epithelien9. Es konnte beobachtet werden, dass HER-2(Human epidermal growth factor receptor 2) in Kombination mit EGFR in vielen Lungenkarzinomen vermehrt exprimiert wird9.
- MMP-9: MMP werden in primären Adenokarzinomen der Lunge exprimiert und spielen im Rahmen der Metastasierung eine wichtige Rolle9.
- VEGF: VEGF fördert die Bildung und das Wachstum von Blutgefäßen9. Seine Rolle im Rahmen des Tumorwachstums ist von grundlegender Bedeutung, denn ohne Vaskularisation können Tumoren nicht größer als 1-2 mm im Durchmesser werden9. Darüber hinaus ist die Angiogenese für die Invasion und die Metastasenbildung unabdingbar9. Zwei der wichtigsten Induktoren der Angiogenese bei Lungenkrebs sind VEGF und der Fibroblasten-Wachstumsfaktor9. Verschiedene Studien konnten eine schlechte Prognose bei hoher VEGF Produktion aufzeigen9.
Metastasierung und Rezidivrate
Die häufigsten Lokalisationen für Metastasen der Bronchialkarzinome umfassen in absteigender Reihenfolge das Gehirn, die Knochen, die Leber und die Nebennieren3. Aber auch die LK und das Rückenmark können betroffen sein4.
Ca. 30-50% der Patienten erhalten nach erfolgreicher operativer Therapie ein Rezidiv, die meisten Patienten (90%) innerhalb der ersten 2 Jahre3. Dabei ist die Rezidivrate für T4 Tumoren und N2 Status am höchsten3. Rezidive können lokoregional (20-40%), in der Ferne (66-74%) oder gemischt (9-14%) in Erscheinung treten3.
Klinik
Bei ca. 10% der asymptomatischen Patienten wird das Tumorwachstum durch eine zufällige Bildgebung (meist Röntgen Thorax) diagnostiziert4. Die meisten Patienten werden jedoch mit Symptomen vorstellig4.
Thorakale Beschwerden, Husten, Dyspnoe und Hämoptysen sind häufig auftretende Symptome im Rahmen eines Bronchialkarzinoms413. Husten tritt bei bis zu 75 Prozent der Patienten auf, Ursache ist meist eine endobronchiale Raumforderung oder eine postobstruktive Lungenentzündung4. Zur Dyspnoe kommt es bei bis zu 60 Prozent der Patienten, und kann durch den tumorbedingten Verschluss des Bronchialsystems bedingt sein4. Intermittierende schmerzende Beschwerden in der Brust treten bei etwa 50 Prozent auf, Hämoptysen bei bis zu 35 Prozent aller Patienten4. Obwohl die akute Bronchitis ist die häufigste Ursache für Hämoptysen darstellt, sollte bei allen Patienten, die älter als 40 Jahre sind, ein Lungentumor ausgeschlossen werden4.
40% der Patienten mit Lungenkrebs präsentieren sich mit Symptomen der intrathorakalen Ausdehnung (direkte intrathorakale Tumorausbreitung, lymphatische Ausbreitung)4, ein weiterer Teil mit einem Lungengrenzen überschreitenden Wachstum. Heiserkeit Aufgrund einer N. recurrens Parese tritt in 2 bis 18% der Fälle auf4. Eine Phrenikusparese kann bei Atemnot mit einem einseitig erhöhten Zwerchfellstand radiologisch gesichert werden4. Der Pancoast-Tumor imponiert durch ein Horner-Syndrom4. Die Brustwandinfiltration präsentiert sich oft mit persistenten, pleuritischen Schmerzen4. Pleuraergüsse können mit Dyspnoe, einem verminderten Atemgeräusch, und Klopfschalldämpfung einhergehen4. Die Obstruktion des Ösophagus kann eine Dysphagie verursachen4. Die obere Einflussstauung kennzeichnet sich durch Schwellung im Gesicht und erweiterte Venen auf dem Oberkörper, der Schultern und der Arme4 und kann sich aufgrund vergrößerter Lymphkotenpakete entwickeln. Obgleich sich eine perikardiale Beteiligung häufig im Rahmen von Autopsien findet, präsentieren sich jedoch nur selten Patienten mit einem symptomatischen Perikarderguss oder -tamponade4.
Fast ein Drittel aller Patienten mit Lungenkrebs präsentieren sich mit Anzeichen und Symptomen von extrathorakalem Wachstum4. Unspezifische Symptome umfassen Schwäche und Gewichtsverlust4. Knochenmetastasen präsentieren sich häufig mit Schmerzen, Frakturen, oder einer erhöhten alkalischen Phosphatase im Labor4. Häufig sind die langen Röhrenknochen oder die Wirbelkörper betroffen4. Tastbare Lymphknoten, insbesondere in der supraklavikulären Grube sind Zeichen einer Fernmetastasierung4. Ca. 10% der Patienten werden mit Hirnmetastasen vorstellig4. Leitsymptome umfassen hier Kopfschmerzen, Übelkeit, Erbrechen, fokale neurologische Defizite, Krampfanfälle, Verwirrung und Persönlichkeitsveränderungen4. Trotz häufiger Leberbeteiligung findet sich eine Erhöhung der Transaminasen im Labor nur relativ selten4.
Rund 10 Prozent der Patienten entwickeln systemische Symptome wie z.B.: das paraneoplastische Syndrom4. Dies wird durch die Freisetzung bioaktiver Substanzen durch den Tumor verursacht bzw. stellt eine Reaktion auf die Tumorprodukte dar4. Die Symptome können der Diagnose vorausgehen, erscheinen aber in der Regel erst spät im Krankheitsverlauf, oder im Rahmen von Rezidiven4. Endokrine Symptome umfassen Hyperkalziämie, Syndrom der inadäquaten ADH Sekretion4, Cushing-Syndrom und Hypoglykämie13. Daneben kann es zu einer hypertrophen pulmonalen Osteoarthropathie (Pierre-Marie-Bamberger-Syndrom) mit Trommelschlägelfingern, Uhrglasnägel und Gelenkschmerzen in Knöcheln, Knien und Händen kommen413. Aber auch das Lambert-Eaton-Syndrom, eine myasthenische periphere Neuropathie und eine kortikale zerebelläre Degeneration können auftreten4. Zusätzlich können sich eine Polymyositis und Dermatomyositis als auch eine Thrombozytose (1/3 der Pat.) und Thromboseneigung entwickeln13.
Diagnostik
- Anamnese und klinische Untersuchung: Tabakkonsum, berufliche Exposition, Tumoren in der Familie, bekannte Lungenerkrankungen. Abgeschwächtes Atemgeräusch und Klopfschalldämpfung bei großen Tumoren, Stauungszeichen, Gewichtsverlust, Fatique u.a.
- Labor: Abnorme Laborwerte finden sich zumeist erst bei Patienten in fortgeschrittenen Tumorstadien und umfassen Anämie, eine erhöhte Alkalische Phosphatase und erhöhte Leberenzyme2.
- Röntgen Thorax: Thorax im Stehen mit p.a. und seitlicher Aufnahme. Zu einem hohen Prozentsatz kann ein pathologischer Befund erhoben werden. Häufig findet sich eine periphere oder zentrale Raumforderung; weitere Röntgenzeichen umfassen Atelektasen, Obstruktionsemphyseme, Abszedierung, Ergussbildung, poststenotische Pneumonie und Karzinomkavernen.
- CT-Thorax (mit KM): Die CT wird bei Verdacht auf Lungentumoren zur genauen Lokalisationsdiagnose als auch zum initialem Staging genutzt3. Charakteristika in der CT bei SCLC umfassen die ein massive Lymphadenopathie und die direkte mediastinale Invasion2. Raumforderungen in oder angrenzend an den Hilus sind besonders charakteristisch für kleinzellige Tumoren und finden sich in ca. 78% der Fälle2. Die CT hat allerdings eine limitierte Sensitivität in Bezug auf die mikroskopische metastatische Tumorausbreitung als auch in der Beurteilung von vergrößerter Lymphknoten (Metastase vs. reaktive Hyperplasie)1. Die LK sollten zur genaueren Beurteilung größer als 1cm sein.
- Sputumzytologie: Die Sputum-Zytologie ist die am wenigsten invasive Methode zur Diagnostik eines Bronchialkarzinoms24. Die diagnostische Genauigkeit ist jedoch abhängig von der Anzahl der Proben (es sind mindestens drei Proben erforderlich), der Entnahmetechnik, der Lokalisation des Tumors (zentral vs. peripher) als auch dessen Größe2. Patientencharakteristika für eine positive Zytologie umfassen Hämoptysen, niedrige FEV1-Werte, große Lungentumoren (2,4 cm), zentral gelegene Tumoren als auch Plattenepithelkarzinome2. Die Sensitivität reicht je nach Anzahl der Sputumproben von 0,42 bis 0,97, die Spezifität von 0,68 bis 1,02.
- Pleurapunktion: Voraussetzung für eine erfolgreiche Punktion ist ein ausreichend punktierbarer Erguss2. Alle Patienten mit Verdacht auf Lungenkrebs, die mit einem Pleuraerguss vorstellig werden, sind zu punktieren2. Die Punktion sollte zunächst der Differenzierung zwischen einem malignen Erguss (maligne Beteiligung der Pleura) und einem paramalignen Erguss (aufgrund anderer Faktoren wie lymphatische Blockade, Atelektasen oder Hypoproteinämie) dienen2. Diese Unterscheidung ist wichtig, da der Nachweis von malignen Zellen maßgelblich das therapeutische Vorgehen am Patienten ändert2. Wenn drei separate Pleurapunktate mit malignen Zellen vorliegen, ist eine positive Diagnose in 80% der Fälle wahrscheinlich2. Wenn der zytologische Befund jedoch zweimal hintereinander negativ ist, sollte eine Thorakoskopie zur Ursachenklärung erfolgen2. Pleurametastasen finden sich häufiger in der viszeralen Pleura können bei großen Tumormassen aber auch die Pleura parietalis betreffen2.
- Pleurabiopsie: Sie ist weniger sensitiv als die Pleurapunktion; nur in 50% der Fälle findet sich eine positive Histologie2. Bei dieser Methode wird blind die Pleura punktiert und eine Biopsie entnommen2.
- _FNA(Fine needle aspiration):_Bei Patienten mit SCLC sollten bei gut zugänglichen Metastasen (supraclavikulär oder mediastinal) diese punktiert werden2.
- TBNA: Die Sensitivität beträgt 0,76 und die Spezifität 0,962, die Untersuchung kann unter Durchleuchtung oder CT-gesteuert durchgeführt werden4.
- TTNA: In verschiedenen Studien beträgt die Sensitivität der TTNA für die Diagnose peripherer Bronchialkarzinome
0,902. Die TTNA eines peripheren Herdes kann entweder unter Durchleuchtung oder via CT-Scan durchgeführt werden24. Zusammenfassend ist die Empfindlichkeit von TTNA für periphere Läsionen höher als die der Bronchoskopie24. Die falsch positive Rate beträgt in etwa 0,01 bis 0,02, die falsch negative Rate ist hingegen hoch (0,20 bis 0,30)2. Aus diesem Grund eignet sich die TTNA nicht zum Ausschluss eines Lungentumors2. - Bronchoskopie: Für die Durchführung der Bronchoskopie ist die Lage des Tumors
(Zentral vs. peripher) für die diagnostische Genauigkeit von Bedeutung2. Zentrale Läsionen sind oft durch ein exophytisches endobronchiales Wachstum gekennzeichnet und lassen sich daher gut bronchoskopieren und biopsieren24. Die Sensitivität der Methode betrug im Rahmen einer großen Studie 0,8824. Die Biopsie mit der Zange aus einer sichtbaren zentralen Läsion ist die Methode der Wahl und geht mit einer Sensitivität von 0,74 einher2. Dabei sollten mindestens drei Biopsien aus der sichtbaren Läsion entnommen werden2. Mit der Anzahl der entnommenen Biopsien steigt die Sensitiviät2. Sie ist bei Bronchiallavagen und Bürstungen etwas niedriger (0,48 und 0,59)2. Die Kombination mit der TBNA bei submuköser Tumorausbreitung und peribronchialen Tumoren führt zum Anstieg der Sensitivität auf 0.952. Periphere Läsionen sind in den meisten Studien definiert als Läsionen, die nicht sichtbar sind und jenseits der einsehbaren segmentalen Bronchien liegen2. Aus diesem Grund ist es nicht verwunderlich, dass die Sensitivität der Bronchoskopie hier geringer ist, als bei zentralen Läsionen und stark von der Größe der Läsionen abhängt2. - EBUS: Mit Hilfe der endobronchialen Sonografie lassen sich Biopsien besser steuern1 und damit die Diagnosesicherheit steigern2.
- Thorakoskopie: Mit Hilfe der videoassistierten Thorakoskopie lassen sich sicher und schonend Gewebeproben der Pleura2, Pleuraflüssigkeit und kleine peripher gelegene Bronchialkarzinome entnehmen4 Die Sensitivität schwankt zwischen 0,80 und 0,99, die Spezifität schwankt zwischen 0,93 und 1, und der negative prädiktive Wert liegt zwischen 0,93 und 0.962. Falsch-negative Ergebnisse finden sich häufiger bei Patienten mit einem Pleuramesotheliom als bei Patienten mit einem primären Lungenkarzinom2.
- Mediastinoskopie: Dieses Verfahren hat nach wie vor die höchste Sensitivität (>0.93) und eine sehr hohe Spezifität im Rahmen des mediastinalen Lymphknotenstagings1. Sie sollte allerdings nur zur Anwendung kommen, wenn die TBNA ohne Erfolg bleibt oder im radiologischen Befund eine mediastinale Infiltration zur Darstellung kommt2.
- Thorakotomie: Für Patienten mit einem frühen Tumorstadium (NSCLC, die einer OP zugeführt werden eignet sich zur Diagnostik und zum Staging die Thorakotomie4.
Umfelddiagnostik:
- CT-Thorax und -Abdomen: Im CT-Thorax können vergrößerte hiläre und mediastinale Lymphknoten zur Darstellung kommen4 Mit Hilfe des CT-Abdomens lassen sich Nebennieren und Lebermetastasen detektieren2. Die Sensitivität der CT liegt bei 0.8, die Spezifität bei 1.04.
- FDG-PET / PET-CT: Dieses Verfahren eignet sich gleichermaßen zur Diagnostik von Lungenrundherden, LK- und Fernmetastasen (ausgenommen Hirnmetastasen)3, zum Staging von Bronchialkarziomen2, zur Bestrahlungsplanung als auch zur Kontrolle des Therapieansprechens3 und hat eine höhere Sensitivität als die CT alleine14. Im Rahmen einer Metaanalyse betrug die durchschnittliche Sensitivität und Spezifität der FDG-PET zum Nachweis einer malignen Läsion 0,97 und 0,782. Allerdings gilt zu beachten, dass auch dieses Verfahren seine Grenzen hat: So kann z.B.: die aktuelle Generation von PET-Scannern Läsionen, die kleiner als 1 cm sind, übersehen, als auch zu falsch negativen Ergebnissen bei Karzinoid-Tumoren, Plattenepithelkarzinomen3 oder bronchoalveolären Karzinomen führen23. Falsch positive Ergebnisse finden sich hingegen bei bestimmten entzündlichen oder infektiösen Läsionen wie Tuberkulose, Aspergillose, M. Wegener, Amyloidose, Histoplasmose und Rheumaknoten23. Zur Beurteilung der Brustwandinfiltration als auch mediastinaler Läsionen ist die PET-CT hingegen nicht geeignet3. Hier ist bei diagnostischer Unsicherheit nach wie vor die Mediastinoskopie zu bevorzugen3.
- CCT/MRT-Schädel: Sie dient der Detektion von Hirnmetastasen vor allem bei Patienten mit SCLC247 als auch bei Patienten mit NSCLC ab Stadium III und bei allen Patienten mit neurologischen Auffälligkeiten5.
- Knochenszintigrafie: Sie dient der Detektion von Knochenmetastasen vor allem bei Patienten mit SCLC [2]47 als auch bei Patienten mit NSCLC ab Stadium III und bei Patienten mit Knochenschmerzen, erhöhten Kalziumwerten und erhöhter Alkalischer Phosphatase im Serum5.
Präoperative Funktionsdiagnostik
Diese sollte vor eingreifenden diagnostischen und therapeutischen Schritten stehen, denn bei schlechter Lungenfunktion verbietet sich von vornherein eine Lungenteilresektion (funktionelle Inoperabilität)13 aufgrund erhöhter OP-Komplikationen4. Durchzuführen ist neben einer Lungenfunktion (mit Fokus auf das FEV₁) die Bestimmung der CO-Diffusion (DLCO) in der Lunge4. Diese Messungen sind ein hilfreicher Indikator zur Einschätzung der Morbidität und Mortalität bei operablen Patienten4. Patienten mit einem FEV₁ oder DLCO Wert von weniger als 80% müssen sich weiteren diagnostischen Untersuchungen unterziehen4. Hierzu zählen die Berechnung der postoperativen pulmonalen Reserve (mit Ventilations- und Perfusionsszintigramm), ein Herz-Lungen-Belastungstest (Spirometrie mit VO₂max Messung, welche > als 25ml/Min/kg betragen sollte13) und eine arteriellen BGA [4]. Patienten mit einem postoperativen FEV₁ oder DLCO Wert von weniger als 40 Prozent und einem VO₂max-Wert von weniger als 10 ml pro kg pro Minute oder einem SaO₂-Wert von weniger als 90 Prozent haben ein erhöhtes Risiko einen perioperativen Tod oder Komplikationen zu erleiden4.
Differentialdiagnose
- Malignes Lymphom: NSCLC als auch SCLC können sich mit weitläufiger Infiltrierung des Mediastinums präsentieren, die als eine Masse definiert ist, umliegende Strukturen mit einbezieht und einzelne Lymphknoten nur schwer erkennbar sind2.
Therapie
- Operation: Die operative Therapie stellt die einzige kurative Möglichkeit in der Behandlung des Bronchialkarzinoms dar, vorausgesetzt der Tumor kann im Ganzen (R0-Situation) reseziert werden1. Das Verfahren der Wahl ist hierbei die Lobektomie1. Dies basiert auf Ergebnissen prospektiver, randomisierter und kontrollierter Studien, die zeigen konnten, dass bei Patienten nach Lobektomie ein längeres Überleben und eine verminderte Lokalrezidivrate bestand, verglichen mit Patienten die einer atypischen Resektion unterzogen wurden1. Die Operationsmortalität liegt bei 1,3%1. Mit Einführung der videoassistierten Lobektomie kam eine weniger invasive Methode zu Anwendung, die es auch ermöglichte, Patienten zu operieren, die aufgrund von Komorbiditäten einem erhöhten Operationsrisiko ausgesetzt waren, und die mit vergleichbaren Überlebensraten einhergeht1. In der Regel werden Patienten bis zum Stadium IIIA einer operativen Therapie zugeführt4. Je nach Tumorgröße kann auch eine Pneumektomie erfolgen5. Anbei sollte immer eine Lymphadenektomie bzw. eine mediastinale LK-Entfernung erfolgen5.
- Chemotherapie: Fast 70% der Patienten mit einem Bronchialkarzinom präsentieren sich zum Diagnosezeitpunkt in einem lokal fortgeschrittenen Tumorstadium, bzw. mit Fernmetastasen1. Generell besteht bei diesen Patienten nach Resektion ein erhöhtes Risiko für ein Rezidiv1. Hier kommt die adjuvante Chemotherapie zum Einsatz1. Weiterhin besteht die Indikation zur Chemotherapie bei allen Patienten nach Tumorresektion mit NSCLC14, in ausgewählten Fällen auch schon im Stadium IB, wenn der Primärtumor größer als 4cm ist, ansonsten besteht kein Benefit für Patienten im Stadium I6, insbesondere aber im Stadium II und III6. Firstline Therapie bei Patienten mit fortgeschrittenen Tumoren ist eine platinbasierte Chemotherapie mit 4-6 Zyklen6. Verschiedene Studien konnten zeigen, dass Patienten mit adjuvanter, platinbasierter Chemotherapie ein besseres 5-Jahres-Überleben zeigen als solche ohne adjuvante Therapie14. Viele Phase III Studien konnten beim fortgeschrittenen BC eine Überlegenheit der systemischen Chemotherapie gegenüber der „best supportive care“ aufzeigen1. Platinbasierte Chemotherapeutika waren auch hierbei Mittel der Wahl1. Weitere Chemotherapeutika in der Therapie des Bronchialkarzinoms umfassen PTX, Docetaxel, Cemcitabin und Vinorelbine alle mit vergleichbar guter Wirksamkeit15. In Diskussion befindet sich derzeit die Anwendung einer präoperativen Chemotherapie4. Verschiedene randomisierte Studien über eine neoadjuvante platinbasierte Chemotherapie konnten bei Patienten im Stadium II und IIIA und N2 Status einen Überlebensvorteil zeigen56, und durch ein Downstaging die Operabiliät ermöglichen13.
- Radiatio: Die Therapie der Wahl bei fortgeschrittenen NSCLC (Stadium III) und nicht vollständig resezierten Tumoren5 ist die Radiatio (Megavolttechnik13) mit 60Gy in 30 Fraktionen1. Konventionelle RT (Radiotherapie) allein resultierte in einer mittleren Überlebenszeit von 10 Monate und einer 5-Jahres-Überlebensrate von 5%1. Eine alleinige Radiatio sollte nur Anwendung finden, wenn die Patienten einer OP nicht zugeführt werden können5. Eine kombinierte Radiochemotherapie ist das Mittel der Wahl bei Patienten mit lokal fortgeschrittenen, inoperablen Stadium III Tumoren und ausreichender Lungenfunktion5.
- Stereotaktische Bestrahlung: Zu den stereotaktischen RT-Techniken gehören neben der ultrapräzisen Behandlungsplanung, die gezielte Bestrahlung des Tumorbetts, und hohe Dosen pro Fraktion1. Sie wird eingesetzt zur Behandlung von kleinen Lungentumoren (T1-2, N0, M0)1.
- Hadron-Therapie: Hadrons sind subatomare Teilchen (Protonen, Neutronen oder Schwerionen) bestehend aus Quarks, die durch starke Kernkräfte beeinflusst werden1. Mögliche Vorteile von Hadron RT im Vergleich zu konventionellen RT (Röntgenstrahlen und Elektronen) umfassen eine höhere relative biologische Effektivität, einen höheren linearen Energietransfer, ein niedrigeres Sauerstoff-Enhancement-Verhältnis und eine exzellente Dosisverteilung1. Nachteile der Therapie sind Komplexität und extrem hohen Kosten1.
- Target Therapie: 40-80% der Patienten mit NSCLC zeigen eine Überexpression von EGFR1. Diese ist in der Regel mit einer schlechteren Prognose vergesellschaftet1. In den letzten Jahren wurden verschiedene EGFR-Inhibitoren entwickelt, entweder in Form monoklonaler Antikörper, oder als Rezeptor-Tyrosin-Kinase-Inhibitoren1. Vor allem weibliche Patienten, Nichtraucher, Patienten mit Adenokarzinomen und asiatischer Herkunft zeigen ein gutes Ansprechen auf die Therapie16. Diese Patientenpopulation zeigt eine hohe Inzidenz an somatischen Mutationen in der Thyrosinkinasedomäne des EGFR-Gens6. Die EGFR-Mutation, als auch die Anzahl der EGFR Gen-Kopien sind damit ein signifikanter positiver prädiktiver Faktor für das progressionsfreie Überleben6. Aus diesem Grunde sollte bei der oben genannten Patientenpopulation routinemäßig ein EGFR Screening erfolgen. Weiterhin sollte diese Therapie als erste Wahl bei Patienten mit nachgewiesener EGFR-Mutation in Erwägung gezogen werden6. Eine Chemotherapie hingegen würde sich als Therapie der Wahl bei Patienten mit unbekanntem EGFR-Status eignen6. Zum Einsatz kommen neben Gefitinib auch Cetuximab und Erlotinib, wobei letzteres gerne als Second- bzw. Thirdline Therapie in Frage kommt15. Erlotinib verlängert das mediane Überleben um ca. 7 Monate1 als auch das progressionsfreie Überleben und wird von der FDA1 als Therapie der Wahl bei Patienten mit fortgeschrittenen NSCLC und ausbleibendem Ansprechen auf die Firstline Therapie propagiert6. Neben der EGFR -Inhibition kommt noch die VEGF -Inhibitionmit u.a. Bevacizumab zum Einsatz1. In Kombination mit platinbasierter Chemotherapie zeigen Patienten mit NSCLC hier ein verbessertes medianes14 als auch ein verbessertes progressionsfreies Überleben56. Vandetanib ist ein oral bioverfügbares Anilquinazolin-Derivat und ein vielseitiger TKI dessen Zielstrukturen VEGFR -2, EGFR, und RET-Tyrosin-Kinasen angreift6. Die Substanz hemmt damit zwei wichtige Signalwege des Tumorwachstums: zum einen die VEGFR -abhängige Tumor-Angiogenese als auch die EGFR -abhängige Proliferation von Tumorzellen und deren Überleben; sie wird derzeit im Rahmen von Studien getestet6. HDAC sind eine Familie von Enzymen, die eine wichtige Rolle im Rahmen der Regulation der Gen-Transkription spielen6. Die Transkriptionsaktivierung wird durch Histonacetyltransferasen vermittelt6. Durch die Zunahme der Histon-Acetylierung kommt es in der DNA vermehrt zu offeneren Konfiguration6. HDAC sind in vielen Tumoren aktiv, sie können durch Inhibitoren inaktiviert werden6. Als Medikament kommt in verschieden Studien Vorinostat, ein kleines Molekül, dass HDAC hemmt, zum Einsatz6. Es fördert nicht nur die Induktion von verschiedenen Genen (Aktivierung von Zytoskelett-Proteinen, Chaperone und Kernimport Faktoren), sondern führt auch zur Unterdrückung mehrerer Gene, wie z.B.: die Thymidylatsynthetase und auch den VEGF-R(Vaskular endothelial growth factor receptor)6.
- Palliative Therapie: Schmerztherapie nach dem WHO-Stufenschema4, Bisphosphonate bei Knochenmetastasen, Chemotherapie mit Gemcitabine, Radiatio (extern, und evtl. endoluminal mit 192Iridium), bronchoskopische Verfahren (Stent, Lasertherapie ev. nach photodynamischer Therapie) und die TPCE kommen als palliative Therapie in Frage13. In ausgewählten Fällen kann die Resektion einzelner Metastasen in Erwägung gezogen werden5.
- _Die Therapie des SCLC umfasst in der Regel eine platin-, und etoposidbasierte Radio-Chemotherapie4, als auch eine prophylaktische Ganzhirnbestrahlung7. Bei Hirnmetastasen ist eine Ganzhirnbestrahlung obligat5. Pat. mit einer limited disease (T1-2, N0, M0) sollten einer chirurgischen Resektion unterzogen werden7. Auch hier sollte wie beim NSCLC die Lobektomie der Pneumektomie vorgezogen werden7. Studien konnten eine bessere lokale Kontrolle als auch eine verbesserte Prognose nach chirurgischer Resektion aufzeigen als mit alleiniger Chemotherapie7. Nichts desto trotz sollte im Rahmen der multimodalen Therapie nach Resektion eine adjuvante Radio-Chemotherapie und eine prophylaktische Ganzhirnbestrahlung erfolgen7. Bei Patienten mit extensive disease kann nach neoadjuvanter Chemotherapie bei gutem Ansprechen auf die Therapie ebenfalls ein operativer Eingriff in Erwägung gezogen werden. Auch hier sollte eine adjuvante Therapie folgen7. Ein Therapieansprechen muss nach zwei, bzw. drei Zyklen Chemotherapie mit Hilfe der Bildgebung kontrolliert werden5.
Prognose
Die 5-Jahres-Überlebensrate bei den NSCLC liegt bei ca. 15%14. Die Erkrankung kann bei Patienten mit Langzeitüberleben (>5 Jahre) auch noch bis zu 10 Jahre nach der Diagnose wiederkehren1. Diese Patienten sind weiterhin extrem anfällig (10-fach höheres Risiko als andere erwachsene Raucher) für die Entwicklung neuer Tumoren im Thorax und Bronchialsystem als auch für andere Tumoren im Kopf Hals Bereich1. Ca. 30-40% der Patienten im Stadium 1A (T1, N0, M0) versterben am fortschreitenden Tumorwachstum9.
Faktoren, die sich als prognostische Marker bei Lungenkrebs entwickelt haben umfassen:
- Grad der Tumordifferenzierung: Patienten mit schlecht differenzierten oder undifferenzierten Karzinomen haben ein 70% höheres Sterberisiko im Vergleich zu denen mit gut differenzierten Karzinomen1. Ein 40% erhöhtes Risiko wurde bei Patienten mit mäßig differenzierten Karzinomen beobachtet1.
- Rauchentwöhnung. Es bestehen signifikante Unterschiede im medianen Überleben zwischen Patienten mit NSCLC die nie geraucht haben, ehemals geraucht haben und aktuell rauchen, wobei ersteres Patientenkollektiv das höchste mediane Überleben aufzeigt1.
- Nahrungsergänzungsmittel: Der Gebrauch von Vitaminen und Mineralstoffen zeigte in verschiedenen multivariaten Analysen bei Patienten mit SCLC und NSCLC eine verbesserten Überlebensrate1. Die Todesrate reduzierte sich um 26% für Patienten mit NSCLC und um 37% für Patienten mit SCLC .1
- Molekulare Tumormarker: Die EGFR Genamplifikation findet sich überwiegend in der asiatischen und westlichen Bevölkerung, geht in der Regel mit einer schlechteren Prognose einher und korreliert mit dem Ansprechen auf EGFR-Inhibitoren1.
- Therapieresistenz: Der Glutathion-Stoffwechselweg ist direkt an der Entgiftung bzw. Inaktivierung platinbasierter Verbindungen beteiligt, was sich negativ auf die Behandlungsergebnisse von Patienten mit Bronchialkarzinomen auswirkt1. Ein weiterer kritischer Mechanismus der Resistenz gegenüber Platin-basierten Chemotherapeutika ist die DNA-Reparatur1. Es wird vermutet, dass Tumorzellen mit reduzierter DNA-Reparatur eine höhere Empfindlichkeit auf die Behandlung haben, was zu einem besseren Ergebnis nach Strahlen-oder Chemotherapie führt, während eine erhöhte Reparaturfähigkeit den Tumor widerstandsfähiger macht und so für eine schlechtere Response verantwortlich ist1. Klinische Studien konnten zeigen, dass die Überexpression von ERCC1 mit einem schlechten Überleben für Gemcitabin – Cisplatin-behandelte Patienten mit NSCLC korreliert1.
- Histologischer Typ13
- Tumorstadium (Ausbreitung): Bei Vorhandensein von Lymphknotenmetastasen verschlechtert sich die Prognose von Patienten mit NSCLC signifikant3. Ist das Tumorwachstum über den ipsilateralen Hemithorax hinausgeschritten, verschlechtert sich ebenfalls das Überleben3 <3% der Patienten mit N3 Stadium leben länger als 5 Jahre3.
- Allgemeinzustand des Patienten13
- Alter und Geschlecht: Frauen zeigen höhere 5-Jahres Überlebensraten als Männer13.
- Immunologisches Verhalten: Eine niedrige Lymphozytenzahl geht mit einer schlechten Prognose einher13.
Beim SCLC beträgt bei Patienten mit limited disease die 5-Jahres-Überlebensrate nach Radiochemotherapie 12-17%, das mediane Überleben hingegen nur 23 Monate7. Ca. 30% aller Patienten präsentieren sich mit einer limited disease7. Bei Pat. mit extensive disease beträgt die 5-Jahres Überlebensrate hingegen nur 2%7. Unbehandelte kleinzellige Lungenkarzinome weisen mit einer mittleren Überlebenszeit von weniger als 3 Monaten und einer nahezu 100%igen Letalität innerhalb des ersten Jahres nach Diagnosestellung eine äußerst ungünstige Prognose auf11.
Vorsorge/Screening
Viele Studien haben Screening-Methoden (Sputumzytogie, Röntgen-Thorax-Aufnahmen und low-dose-CT) untersucht, aber keine konnte zeigen, dass sich durch Screening das Überleben von Patienten mit Bronchialkarzinomen verbessert4. Aus diesem Grund gibt es bis dato keine Vorsorgeuntersuchung für Lungenkrebs4.
Nachsorge
Eine Nachsorge sollte bei allen Patienten in den ersten zwei Jahren im Abstand von 3-6 Monaten erfolgen (Anamnese und körperliche Untersuchung), danach alle 6-12 Monate5. In diesen Abständen hat auch eine Bildgebung zu erfolgen5.
Weiterführende Literatur
Pathophysiologie und Molekulardiagnostik beim nichtkleinzelligen Lungenkarzinom
Heukamp LC, Wolf J, Büttner R: Pathophysiologie und Molekulardiagnostik beim nichtkleinzelligen Lungenkarzinom. Onkologe 17: 670–678, 2011Lung Cancer: Diagnosis and Management
L. G. Collins, M.D., C. Haines, M.D., R. Perkel, M.D., and R. E. Enck, M.D., Lung Cancer: Diagnosis and Management, American Family Physician; January 1, 2007; Volume 75, Number 1Initial Diagnosis of Lung Cancer : ACCP, Evidence-Based Clinical Practice Guidelines (2nd Edition)
M.P. Rivera, A.C. Mehta, Initial Diagnosis of Lung Cancer : ACCP, Evidence-Based Clinical Practice Guidelines (2nd Edition), Chest 2007;132;131-148Non–Small Cell Lung Cancer: Epidemiology, Risk Factors, Treatment, and Survivorship
Julian R. Molina, MD, PhD, Ping Yang, MD, PhD, Stephen D. Cassivi, MD, Steven E. Schild, MD, and Alex A. Adjei, MD, PhD; Non–Small Cell Lung Cancer: Epidemiology, Risk Factors, Treatment, and Survivorship, Mayo Clin Proc. 2008 May; 83(5): 584–594Kleinzelliges Lungenkarzinom
Junker K, Petersen I. Kleinzelliges Lungenkarzinom. Pathologe. 2009. 30:131–140.Aktuelle morphologische Diagnostik bösartiger Lungentumoren
Junker K. Aktuelle morphologische Diagnostik bösartiger Lungentumoren. Pathologe. 2006. 27:90–98.
Referenzen
1 Julian R. Molina, MD, PhD, Ping Yang, MD, PhD, Stephen D. Cassivi, MD, Steven E. Schild, MD, and Alex A. Adjei, MD, PhD; Non–Small Cell Lung Cancer: Epidemiology, Risk Factors, Treatment, and Survivorship, Mayo Clin Proc. 2008 May; 83(5): 584–594
2 M.P. Rivera, A.C. Mehta, Initial Diagnosis of Lung Cancer : ACCP, Evidence-Based Clinical Practice Guidelines (2nd Edition), Chest 2007;132;131-148
3 S. Rankin, PET/CT for staging and monitoring non small cell lung cancer, Cancer Imaging 2008; 8:S27-S31
4 L. G. Collins, M.D., C. Haines, M.D., R. Perkel, M.D., and R. E. Enck, M.D., Lung Cancer: Diagnosis and Management, American Family Physician; January 1, 2007; Volume 75, Number 1
5 G. D’Addario, E. Felip, Non-small-cell lung cancer: ESMO Clinical Recommendations for diagnosis, treatment and follow-up, Annals of Oncology 20 (Supplement 4): iv68–iv70, 2009
6 H. R. Mirshahidi, C. T. Hsueh, Updates in non-small cell lung cancer – insights from the 2009 45th annual meeting of the American Society of Clinical Oncology, Journal of Hematology & Oncology 2010, 3:18
7 N. Koletsis, C. Prokakis, M. Karanikolas, E. Apostolakis, D. Dougenis Current role of surgery in small cell lung carcinoma, Journal of Cardiothoracic Surgery 2009, 4:30E.
8 S. E. Mills, D. Carter, J. K. Greenson, und V. E. Reuter, Sternberg’s Diagnostic Surgical Pathology, Lippincott Williams & Wilkins, Auflage: 4th revised edition
9 V. L. Capelozzi, Role of immunohistochemistry in the diagnosis of lung cancer, J Bras Pneumol. 2009; 35(4):375-382
10 S. Chong, MD, K.S. Lee, MD, M. J. Chung, MD, J. Han, MD, O J. Kwon, MD, T. S. Kim, MD, Neuroendocrine Tumors of the Lung: Clinical, Pathologic, and Imaging Findings, RadioGraphics 2006; 26:41–58
11 K. Junker, Aktuelle morphologische Diagnostik bösartiger Lungentumoren, Pathologe 2006; 27:90–98
12 K. Aumann, J. Günter, N. Freudenberg, Pseudomesotheliomatöses Adenokarzinom der Lunge, Pathologe 2010, 31:283–289
13 Gerd Herold und Mitarbeiter, Innere Medizin 2010
14 W. Böcker, Pathologie; Elsevier GmbH, München, 4. Auflage 2008
Lehrtexte Spezielle Pathologie

<< Respirationstrakt - Tumor >>
Bilder
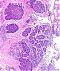
Abb. 550: Basaloides Plattenepithelkarzinom
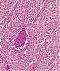
Abb. 551: Großzelliges Karzinom

Abb. 552: SCLC(Small cell lung cancer), erkennbar sind locker verteilte kleine Tumorzellen mit wenig Zytoplasma.
Respirationstrakt - Tumor - weitere Lehrtexte
Respirationstrakt - Tumor - Kasuistiken
Organpathologie-Atlas
Weiterführende Literatur