Prostatakarzinom
Epidemiologie
Das Prostatakarzinom ist mit 25,4% aller diagnostizierten Krebserkrankungen in Deutschland die häufigste Krebserkrankung des Mannes1. Es erkranken jährlich in etwa 58.000 Männer neu an diesem Tumor1. Die Prävalenz beträgt für die 60 bis 70-jährigen zwischen 70/100.000 (US-afroamerikanische Männer) und 14/100.000 (griechische Männer)1. Die altersstandardisierte Inzidenz des Prostatakarzinoms variiert weltweit zum Teil sehr deutlich1. In Europa findet sich z.B.: ein Nord-Süd-Gefälle1. So liegen für Schweden Inzidenzen von 90,9 Erkrankte/100.000 Männer vor, für Spanien werden 35,9 Erkrankte/100.000 Männer angegeben1. Die weltweit am höchsten beschriebene Inzidenz findet sich bei amerikanischen Männern (124,8/100.000), und hier insbesondere aber bei afroamerikanischen Männern (185,4/100.000)115. Die Inzidenz steigt mit zunehmendem Alter des Patienten, wobei das mittlere Erkrankungsalterbei ca. 69 Jahren liegt1. Insgesamt tragen ca. 40% der männlichen Bevölkerung in den westlichen Industrieländern das Risiko, im Laufe ihres Lebens ein Prostatakarzinom zu entwickeln, aber nur etwa 10% werden symptomatisch und nur 3% versterben daran1712. Das Prostatakarzinom variiert regional zum Teil sehr stark15 mit 4,3% in den Entwicklungsländern und bis zu 15,3% in den Industrienationen12. In letzteren ist die Erkrankung nach dem Bronchialkarzinom die zweithäufigste zum Tode führende Tumorerkrankung des Mannes12.Risikofaktoren für die Entstehung eines Prostatakarzinoms
Der größte bislang bekannte Risikofaktor, an einem Prostatakarzinom zu erkranken, ist das Alter15; die Erkrankungshäufigkeit steigt sprunghaft zwischen dem 50. und 60. Lebensjahr an12. Weltweit beträgt das kumulative Risiko in einem Alter von 85 Jahren zwischen 0,5 und 20%12. Autoptische Untersuchungen, bei denen Serienschnitte an den Prostatae von über 90-jährigen gemacht wurden, belegen eine Karzinomhäufigkeit von 70-100%15. (sog. Latentes Karzinom)
Durch zwei Metaanalysen konnte die Assoziation zwischen einer positiven Familienanamnese und dem Risiko, an einem Prostatakarzinom zu erkranken hinreichend belegt werden1. Das Risiko an einem Prostatakarzinom zu erkranken steigt bereits, wenn der Vater oder Bruder daran erkrankt sind15. Dabei liegt das relative Risiko bei 2,5- bis 4,3 % für Verwandte ersten Grades1. Weitere Faktoren, die das relative Prostatakrebsrisiko erhöhen, sind: jüngeres Alter betroffener Familienmitglieder, steigende genetische Übereinstimmung zum betroffenen Familienmitglied und steigende Anzahl individuell betroffener Familienmitglieder1.
Molekularpathologie
Beim Prostatakarzinom wurden in den letzten Jahren Genfusionen der ETS-Familie (ERG, ETV1, ETV4, ETV5) mit verschiedenen Partnern beschrieben, wobei am häufigsten TMPR5SS2 eine Rolle spielte38. Von der Familie der ETS -Transkriptionsfaktoren zeigen vor allem zwei Gene, nämlich ERG und ETV1, konstant hohe Expressionswerte bei Prostatakarzinom-Microarrays8. Diese beiden Gene sind in der Mehrheit der Prostatakarzinomfälle überexprimiert8. Eine Erklärung für die Überexpression liefert eben die Fusion der nichttranslatierten 5’-Region des TMPRSS2-Gens (21q22.3) mit einem der beiden Transkriptionsfaktoren der ETS -Familie, ERG (21q22.2) oder ETV1 (7p21.2)8. Experimentell konnte gezeigt werden, dass die TMPRSS2-ERG -Genfusion zwei unterschiedliche Mechanismen zugrunde liegt: Der häufigere der beiden Mechanismen ist eine Fusion durch Deletion genetischen Materials zwischen den beiden Genen8. Für den anderen, etwas selteneren Mechanismus kommt bisher eine Translokation oder Insertion in Frage8. Die Kombination mit einem Verlust des Tumorsuppressors PTEN scheint dabei ein Indikator für eine schlechte Prognose zu sein3. Als Goldstandard für den Fusionsnachweis im Gewebe dient die FISH als kombinierter zytogenetisch-histomorphologischer Test8. Viele unabhängige Studien konnten bestätigten, dass die TMPRSS2-ERG -Fusion ein häufiges Ereignis beim Prostatakarzinom ist8. Für die Prävalenz der TMPRSS2-ERG -Prostatakarzinome reichen die Werte je nach Kohorte und Untersuchungsmethode von 15–70%8. Die TMPRSS2-ERG -Fusion findet sich nur in Prostatakarzinomen und in knapp 1/5 der „High-grade-PIN -Läsionen“, die in unmittelbarer Nähe von Karzinomherden mit demselben Fusionsmuster zu liegen kamen8. Im gesunden Prostatagewebe als auch bei der BPH und den inflammatorischen Erkrankungen ist die Genfusion hingegen nicht nachweisbar8. Damit konnte gezeigt werden, dass sie ein frühes Ereignis in der Entwicklung und Progression von Prostatakarzinomen darstellt8 und damit in der prädiktiven Diagnostik eine wesentliche Rolle einnehmen kann. Weiterhin konnte in großen Studien festgestellt werden, dass TMPRSS2-ERG -Prostatakarzinome unbehandelt einen aggressiveren Verlauf nehmen, als ein Fusions-negativer Tumor8.
Anatomie
Anatomische Grundlage für Beschreibungen und Beurteilungen der Prostata ist das anatomische Prostatamodell nach McNeal mit Einteilung der Prostata nach ihrer Embryogenese und der Histogenese des Karzinoms in drei Zonen: zentrale Zone (10 % der Prostatakarzinome), Transitionalzone (15 bis 20 % der Prostatakarzinome, meist so genannte inzidente Karzinome) und periphere oder posterolaterale Zone (70 bis 75 % der Prostatakarzinome, manifeste Karzinome)1.
Es gilt folgende anatomische Besonderheiten der Prostata zu beachten:
- Die so genannte „Kapsel“ besteht lediglich aus unscharf begrenztem fibromuskulärem Stroma1. Die Diagnose pT3a darf nur bei eindeutiger Kapselüberschreitung (Tumor im Fettgewebe) vergeben werden1.
- Im Bereich von Apex, neuromuskulärem Bündel, Blasenausgang und anterior fehlt eine „Kapsel“1. Dafür findet sich im Apexbereich und anterior quergestreifte Muskulatur1. Die Diagnose einer extraprostatischen Ausbreitung ist in diesen Lokalisationen erschwert bis unmöglich1. Es darf nur die Diagnose einer Blasenhalsinfiltration (pT4) gestellt werden, wenn typische Harnblasendetrusormuskulatur (Muscularis propria) infiltriert ist1.
- Wegen der prognostischen Relevanz des R-Status und dem häufigen Vorkommen multifokaler Prostatakarzinome sollen radikale Prostatektomiepräparate komplett eingebettet werden1.
- Der tumorfreie Randsaum ist nicht gleichzusetzen mit dem R-Status, da sich dieser auf das Vorhandensein eines Residualtumors jeder Lokalisation bezieht (z. B. auch Fernmetastase)1. Bei mikroskopischem Tumorbefall des Absetzungsrandes ist dementsprechend von einem R1-Status auszugehen, bei makroskopischem Tumorbefall von einem R2-Status1.
Makroskopie
Makroskopisch sind beim Prostatakarzinom derbe, graugelbe, relativ scharf begrenzte Herde zu erkennen, die je nach Stadium in einem oder beider Lappen auftreten können15. Es entsteht fast immer in der peripheren, androgenabhängigen Zone und wächst dann erst Richtung Zentrum und/oder durchbricht die Kapsel, breitet sich im periprostatischen Binde- und Fettgewebe aus bzw. infiltriert die anliegende Samenblase15.
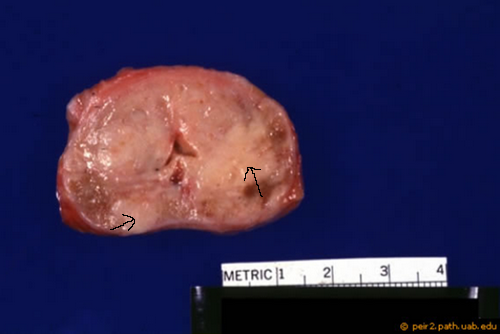
Abb. 630: Prostatektomiepräparat mit einem großen Tumorherd im rechten Prostatalappen und einem weiteren kleineren Herd im linken Lappen (hellere Areale). Quelle: PEIR Digital Library Image# 3670, peir2.path.uab.edu.
Mikroskopie
Die histologische Prostatakarzinomdiagnostik basiert im Wesentlichen auf der Beurteilung der epithelialen Prostatazellen11. Normale Prostatadrüsen bestehen aus 2 verschiedenen Zelltypen: außen findet sich eine Basalzellschicht, innen liegen die sekretorischen Zellen11. Neben dem Bestehen von zytologischen Atypien in den sekretorischen Zellen sind Prostatakarzinome durch den Verlust von Basalzellen charakterisiert11. Das sichere Erkennen eines Basalzellenverlustes ist deswegen die wichtigste Voraussetzung für eine sichere Prostatakarzinomdiagnostik11. Zur Diagnose des gewöhnlichen Prostatakarzinoms sind daneben weitere histomorphologische Kriterien erforderlich: Architekturstörungen, Kernatypien und Ausschluss einer benignen Läsion1.
Sind nur zwei der genannten Kriterien vorhanden, sollte die Diagnose atypischer Drüsen bzw. einer so genannten atypischen mikroglandulären Proliferation ( ASAP oder ATYP ) gestellt werden1. Diese sollte weiter unterteilt werden in „wahrscheinlich gutartig“, „wahrscheinlich bösartig“ oder „unklarer Dignität“1. Bei Patienten mit der Diagnose ASAP findet sich eine Rate an invasiven Karzinomen bei bioptischer Kontrolle von 42-48 %1. Aus diesem Grund sollte hier eine Rebiopsie erfolgen1.
Zum Nachweis des Fehlens von Basalzellen um die Formationen des gewöhnlichen Prostatakarzinoms sollten in unklaren Fällen immunhistochemische Färbungen sowohl für p63 wie für Basalzellkeratine durchgeführt werden1.
Die sogenannten PIN -Läsion wird in eine „Low-Grade“ und eine High-Grade -PIN -Läsion unterteilt1. Nur die High-Grade –PIN gilt als fakultative Vorläuferläsion und (insbesondere bei multifokalem Auftreten in Stanzbiopsien) als Indikatorläsion des Karzinoms der peripheren Zone1.
In der Biopsie sind vor allem das Vorhandensein überfüllter als auch kleiner Drüsen, die zwischen größeren benignen Drüsen zu liegen kommen, suspekt auf ein Karzinom2. Im Vergleich zu benignen Zellformationen mit blassem bis klarem Zytoplasma können die neoplastischen Drüsen ein amphophiles Zytoplasma aufweisen2. Auch können scharfe luminale Grenzen und das Fehlen von Lipofuszin ein Hinweis auf Malignität sein2. Oft sind in den Tumorzellen die Zellkerne vergrößert und es finden sich prominente und vergrößerte Nukleolen oder eine nukleäre Hyperchromasie2. Intraluminales rosafarbenes azelluläres dichtes Sekret oder bläuliche muzinöse Sekrete in kleinen atypischen Drüsen können als zusätzliche Parameter betrachtet werden, um die malignen Drüsen von jenen Benignen zu unterscheiden2. Eine weitere Pathologie die eher selten in benignen Drüsen gefunden wird, ist der Nachweis von Kristalloiden2. Prostatische Kristalloide sind dichte, eosinophile, kristalloide Strukturen, die in verschiedenen geometrischen Formen erscheinen und in etwa 60% der Prostata-Adenokarzinome gefunden werden, hier bevorzugt in gut differenzierten Tumoren2. Bei der Differentialdiagnose zwischen einer Adenose und einem Low-grade-Adenokarzinom ist der Nachweis von Kristalloiden nicht hilfreich2. Wenn hingegen viele kleine atypische Drüsen zwischen größeren benignen Drüsen infiltrierend wachsen, kann der Nachweis der Kristalloide helfen, einen Tumor zu diagnostizieren, und diesen so von einer Adenose abgrenzen2. Kristalloide können auch in verstreuten benignen Drüsen gesehen werden2.
Während die nuklearen Eigenschaften eine herausragende Rolle bei der Diagnose von Adenokarzinomen in Nadelbiopsien spielen, sind sie weniger hilfreich bei der Diagnose von Low-grade-Adenokarzinom in TURP -Präparaten2. Nur selten finden sich hier vergrößerte Zellkerne, prominente Nukleoli und Mitosen2. Zytoplasmatische Merkmale sind oft auch nicht sehr hilfreich, da das Zytoplasma der Zellen wie bei den gutartigen Drüsen häufig blass und klar erscheint2. Das wichtigste Kriterium bei der Diagnose von Low-grade-Adenokarzinomen in TURP -Präparaten ist das architektonische Wachstumsverhalten des Tumors2. Gutartige Prostata Drüsen neigen eher dazu, als umschriebene Knötchen zu wachsen, während das Adenokarzinom der Prostata kein strukturiertes Wachstum aufzeigt2.
Einige Prostatatumoren ähneln gutartigen Prostata-Drüsen sowohl in ihrem architektonischen Muster als auch in ihren zytologischen Merkmalen und dürfen nicht als bösartige Strukturen fehlgedeutet werden2. Das atrophische Adenokarzinom imitiert z.B. die gutartige Prostataatrophie und zeichnet sich durch folgende Strukturen aus2:
1. infiltratives Wachstumsmuster,
2. Präsens von Makronukleoli
3. Nachweis benachbarter, nicht atrophischer Tumorformationen
Ein weiteres ungewöhnliches Erscheinungsbild einer Tumormanifestation im Rahmen der Stanzbiopsie sind Tumoren mit einem voluminösen xanthomatösen Zytoplasma, mit kleinen Kernen und oft keinen oder nur minimalen zellulären Atypien, die auch als “schäumendes Drüsenkarzinom” bezeichnet werden2. Intraluminal findest sich recht häufig ein rosafarbenes homogenes Sekret2.
Daneben gibt es aber noch eine weitere Tumorentität, die in der Lage ist, gutartige Prostataveränderungen zu imitieren2. Hierbei handelt es sich um das pseudohyperplastische Adenokarzinom2. Diese Tumoren zeichnen sich durch größere Drüsen aus, welche häufig verzweigt sind und papillären Einfaltungen enthalten2. Die Erkennung dieser Tumoren basiert auf dem architektonischen Muster, das sich aus zahlreichen dicht gedrängten Drüsen sowie nuklearen Auffälligkeiten zusammen setzt2. Eine Variante des pseudohyperplastischen Adenokarzinoms besteht aus zahlreichen großen Rücken an Rücken sitzenden Drüsen mit geraden luminalen Grenzen und reichlich Zytoplasma2. Gutartige Drüsen haben im Vergleich papilläre Einfaltungen, gekräuselte luminale Grenzen oder ein atrophisches Zytoplasma2. Die Verwendung von Keratin oder p63 ist oft für die Diagnose dieser Tumoren von wesentlicher Bedeutung2.
Es gibt weiterhin drei Kriterien, die bisher nicht in benignen Drüsen bestätigt wurden, und so für die Tumordiagnose eine wichtige Rolle spielen2. Hierzu zählt die perineurale Invasion, die muzinöse Fibroplasie und die glomerulären Drüsenformationen2. Obgleich perineurale Vertiefungen auch bei gutartigen Prostata-Drüsen gefunden wurden, betreffen diese nur die Kante der Nerven, während bei maligen Drüsen regelrecht eine Ummauerung zu sehen ist2.
Histopathologische Untersuchungen zeigen, dass Prostatakarzinome in ca. 80% der Fälle multifokal wachsen, wobei die verschiedenen Herde oft voneinander unabhängig und z. T. makroskopisch-pathologisch nicht erkennbar sind6.
Immunhistochemie
Geeignete immunhistochemische Marker zur Diagnose des gewöhnlichen Karzinoms umfassen14:
- Basalzelkeratine (34βE12, CK5/6): Ihr Fehlen in Karzinomdrüsen ist wegweisend für die Tumordiagnose2413. Da aber auch gutartige Prostata-Drüsen bei Färbungen mit diesen Antikörpern Heterogenität zeigen, ist ein negativer Befund Basalzell-spezifischer Marker in nur wenigen Drüsen noch lange kein Beweis für Malignität213. Selbst unter optimalen Farbebedingungen können auch benigne Drüsen und mikroglanduläre Proliferationen (z. B. AAH ) immunhistochemisch keine Basalzellschicht aufweisen13. In Fällen von Erkrankungen, die ein Tumorwachstum imitieren können, kann ein positiver Nachweis in den meisten Fällen jedoch als gutartig betrachtet werden213. Es sei aber zu beachten, dass in bis zu 0,3% der Karzinome eine fokale CK5/6-Positivität nachweisbar ist4. Häufig liegen diese Zellen dann in einer basalzelluntypischen, luminalen Verteilung vor4. Besonders hilfreich sind die Basalzellmarker zum Ausschluss eines Prostatakarzinoms nach Bestrahlung, die z. T. tumorförmige atrophische Läsionen verursachen kann13.
- p63: Der Transkriptionsfaktor p63 ist ein etwas sensitiverer Marker, der auch in den häufig hyperplastischen Drüsen der transitionalen Zone eine zuverlässigere Basalzellmarkierung gewährleistet als die Basalzellzytokeratine413.
- AMACR: Hierbei handelt es sich um ein Enzym, welches in der β-Oxidation von verzweigtkettigen Fettsäuren und deren Derivate beteiligt ist, und bei Prostatatumoren hochreguliert wird213. In der Immunhistochemie, sind die meisten Tumoren für AMACR positiv (zwischen 87% und 100%)211. Tumorvarianten, die besonders schwer zu diagnostizieren sind, wie pseudohyperplastische-, atrophische- und schaumige Tumordrüsen, zeigen eine Positivität von etwa 60% bis 80%2. Die AMACR ist nicht prostatakarzinomspezifisch13. Ein Nachweis ist ebenfalls bei kolorekalen und hepatozellulären Karzinomen sowie bei Nierenzell- und Urothelkarzinome möglich13. Weitgehend negativ sind Adenokarzinome der Lunge, der Mamma, des Pankreas und der Speicheldrüsen13. Darüber hinaus können aber auch die PIN¸eine einfache Hyperplasie4, atypische mikroazinäre Proliferationen der AAH13 und histologisch benigne Drüsen im Rahmen der Adenose positiv für diesen Marker sein2. Ein positiver immunhistochemischer Befund ist somit alleine nicht beweisend für ein Prostatakarzinom13. Der Einsatz von AMACR ist dann sinnvoll, wenn ein Verdacht auf Malignität bestätigt werden soll2. Aber auch hier gibt es vollständig AMACR -negative Tumoren (bis zu 5% der Prostatakarzinome) und eine erhebliche Heterogenität in der Immunreaktivität413. Die AMACR -Immunhistochemie hat offensichtlich auch eine prognostische Bedeutung13. Ihre verminderte Expression korreliert bei höheren Gleason-Graden mit dem PSA -rezidivfreien Intervall und dem tumorspezifischen Überleben13.
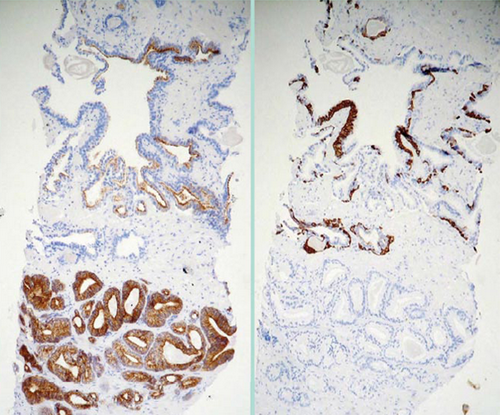
Abb. 629: Immunhistochemie an der Prostatastanze.
Rechtes Bild: Das Tumorgewebe ist positiv für AMACR
Linkes Bild: Die Tumorzellen lassen sich mit Basalzelkeratinen (34βE12, CK5/6) nicht anfärben. Ihr Fehlen in Karzinomdrüsen ist wegweisend für die Tumordiagnose
- EPCA: EPCA zählt zu einer neuen Klasse von Markern, die auf die Erfassung prämaligner Prostataveränderungen, die unterhalb der Detektionsgrenze in der Lichtmikroskopie liegen, abzielt13. EPCA ist ein Gen, das nicht nur in der High Grade PIN und im Prostatakarzinom, sondern auch im histologisch unauffälligen Drüsenparenchym von Prostatakarzinom-Patienten überexprimiert wird, während das Prostataepithel von tumorfreien Prostatae keine oder nur eine schwache Expression aufweist13. Demzufolge erfasst dieser Marker frühe prämaligne Prostataveränderungen, die lichtmikroskopisch noch nicht manifest sind13. Ein potenzieller Anwendungsbereich des EPCA -Tests ist die tumorfreie Prostatastanzbiopsie13. Der immunhistochemische Nachweis einer starken Expression von EPCA in benignen Prostatadrüsen ist Ausdruck einer Felderkrankung und eines erhöhten Krebsrisikos13. Nach den bislang veröffentlichten Daten liegt die Sensitivität und Spezifizität des EPCA -Tests bei 84 bzw. 85%13.
- TARP: Hierbei handelt es sich um ein brust- und prostataspezifisches Antigen, das zwar in 85% der Prostatakarzinome mit einer Überexpression einhergeht, jedoch häufig einen geringen Kontrast zwischen benignem und malignem Epithel zeigt4. Seine stellenweise starke Positivität in hyperplastischen benignen Drüsen und Drüsen mit fraglicher Epitheldysplasie/“Low-grade“-PIN schränkt seinen diagnostischen Nutzen erheblich ein4.
- FASN: Die Hochregulation der Fettsäuresynthase FASN ist im Prostatakarzinom schon mehrfach beschrieben worden4. Im direkten Vergleich zu AMACR zeigt sich in vielen Fällen ein nahezu gleichartiges Bild4. Allerdings gibt es auch Fälle, in denen die FASN der AMACR klar überlegen ist4. So konnten zum Bsp. 30 von 33 AMACR -negativen Karzinomen durch einen FASN -Nachweis richtig identifiziert werden4.
- GOLPH2: Die Überexpression von GOLPH2 im Prostatakarzinom ist durch Genexpressionsanalysen schon länger bekannt; seine Eignung als Gewebebiomarker wurde jedoch erst in den letzten Jahren gezeigt4. GOLPH2, dessen Funktion noch weitgehend unbekannt ist, kommt im Normalgewebe vor allem im Epithel des Golgi- Apparats in geringer Menge vor; im angrenzenden Prostatakarzinom lässt sich ein deutlich kräftigeres und raumgreifenderes Signal nachweisen4. Schwächen von GOLPH2 sind die starke Überexpression auch in hyperplastischem Normalgewebe und seine Expression in jeglichem Normalgewebe4.
- PSA: Eine weitere wichtige diagnostische Säule, in der prostataspezifische Marker zum Einsatz kommen, liegt in der Abklärung von Metastasen bzw. der Absicherung des Primarius4. Hier hat sich das PSA als weitgehend prostataspezifisch gut bewährt4. Allerdings ist es gerade bei zunehmender Tumordedifferenzierung häufig nur schwach exprimiert oder kann gar ganz verloren gehen, was seine relativ geringe Sensitivität begründet4.
- PSMA: Aufgrund der oben genannten Nachteile des PSA bei dedifferenzierten Tumoren kommt vor allem das PSMA in der Tumorentitätsklärung zum Einsatz4. Dies ist insofern sinnvoll, als das PSMA gerade mit zunehmender Dedifferenzierung hochreguliert und auch in Metastasen zumeist kräftig exprimiert wird4. Nachteilig ist jedoch seine fehlende Prostataspezifität, da auch andere Tumoren, wie z. B. das papilläre Nierenzellkarzinome, Blasenkarzinome und gastrointestinale Karzinome PSMA -positiv sein können4.
- Androgenrezeptor: Fast alle Prostatakarzinome exprimieren, selbst im androgeninsensitiven Tumorstadium, ausgedehnt den Androgenrezeptor13. Hohe Expressionsraten sind assoziiert mit einem aggressiven Verlauf und einem verkürzten PSA -rezidivfreien Intervall nach Prostatektomie13. In seltenen Fällen gibt es undifferenzierte Karzinome in der Prostata, die PSA weitgehend negativ sind und sich nicht näher klassifizieren lassen. Wenn in einem derartigen Tumor der Androgenrezeptor immunhistochemisch zweifelsfrei nach gewiesen werden kann, dann sollte der Tumor als Prostatakarzinom klassifiziert und als solches behandelt werden13. Das Gleiche gilt für sarkomatoide Karzinome der Prostata13.
- Neuroendokrine Marker: CGA ist neben Serotonin der beste Marker zum Nachweis einer neuroendokrinen Differenzierung in der Prostatapathologie13.
- Urotheliale Marker: Urotheliale Marker (Ck 7, Ck 20, Uroplakin) sind diagnostisch außerordentlich hilfreich in der Abgrenzung eines Urothelkarzinoms bei gering differenzierten, PSA-negativen Karzinomen der Prostata13. Ck 7 und Ck 20 sind zwar typische, jedoch keinesfalls spezifische Marker für Urothelkarzinome13.
Tumorausdehnung
| Besonderheiten | |
|---|---|
| Extraprostatisches Wachstum | Schwierigkeiten bei der Diagnose der extraprostatischen Tumorausdehnung entsteht, wenn der Tumor die Prostata infiltriert und eine dichte desmoplastische Antwort im periprostatischen Fettgewebe induziert2. Wegen dieser Reaktion kann es schwierig sein zu beurteilen, ob der Tumor bereits außerhalb der Drüse zu liegen kommt, oder sich noch innerhalb der Prostata befindet2. Ein extraprostatisches Wachstum tritt bevorzugt an den posterioren und posterolateralen Arealen der Prostata auf2. Ihr Grad variiert von nur wenigen Drüsen außerhalb der Prostata, auch fokales extraprostatisches Wachstum genannt, bis hin zu Fällen mit umfangreicheren extraprostatischen Wachstum, das entsprechend als nicht-fokal extraprostatisches Wachstum bezeichnet wird2. Weiterhin korreliert es mit dem Risiko einer Progression nach RPE2. |
| Invasion der Samenblase | Obgleich die Invasion der Samenblase als auch das extraprostatische Wachstum bereits das pathologische Stadium T3 definieren, stellt ersteres eine weitaus schlechtere Prognose dar, einhergehend mit einer 5-Jahres-Progressionsrate von 65% nach Operation2. Der häufigste Weg der Samenblaseninvasion erfolgt durch Tumorzellen an der Basis der Drüse mit Wachstum und Ausdehnung in das periseminale Weichgewebe und von dort schließlich in die Samenblasen2. Weniger häufig findet sich eine direkte Ausbreitung über den ductus ejaculatorus in die Samenblasen2. Am seltensten sind diskrete Metastasen in der Samenblase2. Von einer Invasion der Samenblase sollte bereits gesprochen werden, wenn Tumor die muscularis infiltriert2. |
| Lymphknotenbefall | Die Inzidenz von Lymphknotenmetastasen ist in den letzten Jahren zurückgegangen, da die meisten Tumoren durch moderne Screening-Techniken bereits früh erkannt und therapiert werden2. Sie korreliert mit dem klinischen Stadium, dem präoperativen PSA -Wert, und dem Gleason-Grade in der Biopsie2. Da der Nachweis von Lymphknotenmetastasen mit einer kurativen Operation nicht mehr vereinbar ist, wird häufig eine pelvine Lymphadenektomie mit Schnellschnitt durchgeführt2. Fast alle Patienten mit positiven Lymphknoten, die sich einer RPE unterzogen haben, zeigen einen Progress ihrer Erkrankung, vor allem was okkulten Fernmetastasen betrifft2. Nichts desto trotz betragen die 5 – und 10-Jahres Überlebensraten bei Patienten mit positiven Lymphknoten, und radikaler Prostatektomie 97% und 62%2. In den Fällen, in denen ein präoperative Gleason-Score von <8 vorliegt, ist das Zeitintervall bis zum Auftreten von Fernmetastasen besonders lang2. |
| Positive Resektionsränder | Die Inzidenz positiver Resektionsränder richtet sich nach dem klinischen Stadium der Patienten2. Sie variiert zwischen 1.5% für T1c (nicht tastbare) Tumoren bis hin zu 30%-40% für größere tastbare Läsionen2. Der Apex ist eine der häufigsten Stellen, wo ein positiver Resektionsrand vorliegt2. Aber auch in posterioren (Rektum), posterolateralen (Nervenbündel) und lateralen (Beckenwand) Resektionsrädern lässt sich ebenfalls häufig Tumormasse nachweisen. Grund hierfür ist, dass diese Ränder meist parallel zu den Tumoren liegen, eine Resektion in diesen Bereichen aufgrund der umgebenden Organe und Nervenbahnen nur bedingt möglich ist und postoperativ für den Patienten erhebliche Konsequenzen haben kann (Impotenz)2. Der proximale Rand bei einer RPE besteht aus dem Blasenhals, also aus dicken Muskelbündeln2. Finden sich hier Tumorzellen, spricht dies für ein fortgeschrittenes Tumorwachstum2. Der vordere Rand kann in einem kleinen Prozentsatz bei T2 und T1c Tumoren (klinisches Stadium) noch Tumorzellen enthalten2. Wenn der Tumor auf die Drüse begrenzt ist, hat die Kapsel-Oberfläche eine glatte, abgerundete Kontur bei geringer Vergrößerung der Prostata2. In diesen Fällen können trotz schmaler Resektionsränder diese Tumorfrei sein2. Ein positiver Resektionsrand kann auch als Folge einer Kapselinzision entstehen2. |
| Gefäßinvasion | Eine Gefäßinvasion ist in RPE -Präparaten ungewöhnlich2. Sie findet sich nur bei 7% der Tumoren, die kleiner als 4 cm³ sind. (die meisten Tumoren bei radikaler Prostatektomie sind kleiner als 2 cm³)2 |
| Perineurale Invasion | Die perineurale Invasion stellt eine Verlängerung des Tumors entlang einer Ebene dar, an der der Widerstand verringert ist2, und findet sich in nahezu allen Prostatektomiepräparaten mit Prostatakarzinom3. Nach dem jetzigen Stand der Erfahrungen hat sie keine prognostische Bedeutung23. Einzelne Untersuchungen konnten jedoch zeigen, dass jene Seite, in der eine perineurale Invasion bereits in der Biopsie nachgewiesen werden konnte, häufiger eine extraprostatische Tumorausbreitung aufweist3. Vor allem Adenokarzinome der peripheren Zone haben die Tendenz, die Prostata über perineurale Invasion zu verlassen2. Sie ist nicht mit einer Invasion in Lymphgefäße gleichzusetzen2. |
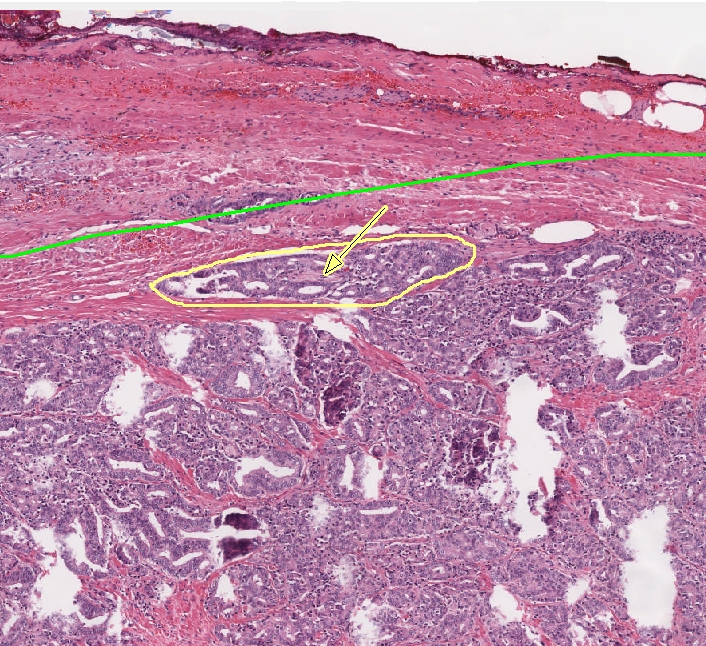
Abb. 203: Invasionsfront des Tumors mit Perineuralscheideninfiltration (gelb)
| Besonderheiten | |
|---|---|
| Fernmetastasen | Die Fernmetastasierung erfolgt hämatogen vor allem retrograd über die klappenlosen prävertebralen Venenplexus in den Knochen15. Betroffen sind zumeist die Wirbelsäule, der Femur und das Becken. 90% der Knochenmetastasen sind vom osteoblastischen Typ15. Die Tumorzellen produzieren dabei eine Substanz (prostatic osteoblastic factor), die Osteoblasten direkt zum Wachstum stimulieren15. |
Weitere Tumoren der Prostata
Als gewöhnliches Prostatakarzinom wird das epitheliale Adenokarzinom bezeichnet, das die überwiegende Mehrzahl der Prostatakarzinome ausmacht1. Die WHO -Klassifikation von 2004 führt weiterhin seltene und besonders differenzierte Prostatakarzinome (z.B. Prostatakarzinom mit zahlreichen endokrinen Zellen, pseudohyperplastisches, atrophes, xanthomatöses, muzinöses, duktales, siegelringzelliges und sarkomatoides Karzinom, Basalzellkarzinom, Urothelkarzinom, Plattenepithelkarzinom, gut differenzierter neuroendokriner Tumor = Karzinoid, schlecht differenziertes neuroendokrines Karzinom = kleinzelliges Karzinom) sowie gutartige und atypische Läsionen auf, die von gewöhnlichen Prostatakarzinomen abgegrenzt werden müssen ( PIN, adenomatöse, cribriforme, postatrophe Hyperplasie, sklerosierende Adenose, nephrogenes Adenom, Verumontanum-Drüsen-Hyperplasie, Samenblasenepithel, Cowper-Drüsen etc.)1. Einige wichtige Entitäten sind nachfolgend genannt:
| Tumorentität | Besonderheiten |
|---|---|
| Muzinöses Adenokarzinom | Die Diagnose des muzinösen Adenokarzinoms der Prostata kann gestellt werden, wenn mindestens 25% des Tumors extrazelluläres Mucin enthält2. Histologisch sind muzinöse Adenokarzinome der Prostata überwiegend Intermediate-Grade-Tumoren, in denen ein kribriformes Wachstumsmuster in den muzinösen Bereichen dominiert2. Sie haben ein aggressives biologisches Verhalten und wie die nicht muzinösen Tumoren die Fähigkeit, bei fortgeschrittener Erkrankung Knochenmetastasen zu bilden2. Im Gegensatz zu Blasenkarzinomen enthalten muzinöse Adenokarzinome der Prostata selten Siegelringzellen2. |
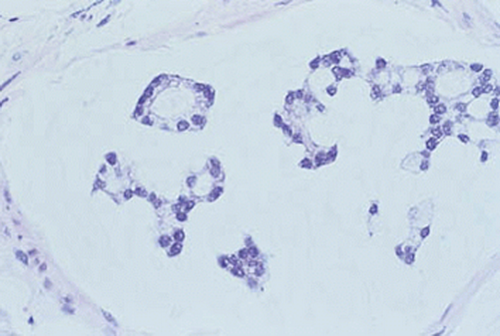
Abb. 618: Muzinöses Adenokarzinom der Prostata. Erkennbar sind mit Muzin gefüllte Tumorzellen. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
|
| Tumoren mit neuroendokriner Differenzierung | Neuroendokrine Zellen sind sowohl im benignen als auch malignen Prostatadrüsenepithel nichts Ungewöhnliches2. Vor allem mit CGA13 und Serotonin lassen sich die Zellen immunhistochemisch gut darstellen1. Gelegentlich können diese Zellen auf H&E-gefärbten Schnitten durch ihre basalständigen feinen eosinophilen zytoplasmatischen Granula erkannt werden213. Die meisten dieser Zellen zeigen keine klinischen Anzeichen einer ektopen Hormonausschüttung2. Kleinzellige Karzinome der Prostata haben ein ähnliches zytologisches Erscheinungsbild wie die kleinzelligen Karzinome der Lunge213. In etwa 50% der Fälle sind die Tumoren gemischtzellig2. In der Immunhistochemie ist die kleinzellige Komponente typischerweise negativ für PSA und Androgene213. Davon abzugrenzen sind undifferenzierte, relativ kleinzellige Prostatakarzinome mit Expression von PSA und Androgenrezeptor und ggf. mit fokaler granulären CGA -Positivität13. In diesem Fall profitiert der Patient von einer Androgenentzugstherapie und hat eine deutlich bessere Prognose als Patienten mit kleinzelligen Prostatakarzinomen, bei denen die mediane Überlebenszeit ca. 12 Monate beträgt13. Obwohl bei den meisten kleinzelligen Karzinomen der Prostata eine klinisch manifeste Hormon-Produktion fehlt, stehen sie für die Mehrheit der Prostatatumoren mit klinisch sichtbarer ACTH oder ADH -Produktion2. Die durchschnittliche Überlebenszeit von Patienten mit einem kleinzelligem Karzinom der Prostata beträgt weniger als 1 Jahr2. Dabei gibt keine Unterschiede in der Prognose zwischen Patienten mit einem reinen kleinzelligen Karzinom und solchen mit gemischtzelligen Tumoren2. |
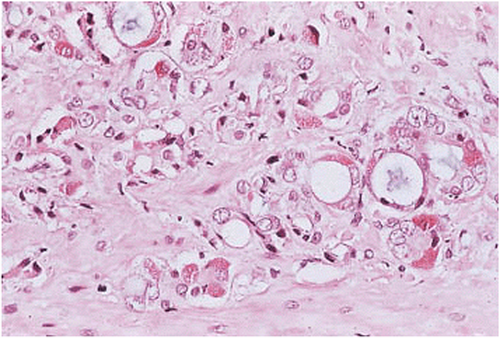
Abb. 616: Prostatakarzinom mit neuroendokriner Differenzierung, (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
|
| Duktales Adenokarzinom der Prostata | Während die meisten Adenokarzinome der Prostata azinären Ursprungs sind, entstehen ca. 0,4% bis 0,8% der Tumoren aus den Ductuli der Prostata2. Etwa 5% der Tumoren zeigen sowohl eine duktale als auch eine azinäre Differenzierung2. Wenn diese Tumoren in den großen periurethralen Prostatakanälen auftreten, können sie als exophytische Läsionen in die Harnröhre wachsen2. Tumoren, die den peripheren Prostatakanälen entstammen, können, müssen aber keine Harnröhrenkomponente aufweisen2. Zytologisch, bestehen die duktalen Adenokarzinome der Prostata aus hohen säulenartigen pseudostratifizierten Epithelzellen mit amphophilen Zytoplasma, welches auch blass oder klar imponieren kann2. Die Tumorzellen sind zumeist papillär angeordnet2. Ein weiteres Muster das bei duktalen Tumoren beobachtet wird, sind kribriforme Formationen2. Das kribriforme Wachstumsmuster ist durch große Acini, die Rücken-an-Rücken stehen und mit intraglandulären epithelialen Brücken verbunden sind, was zur Bildung von schlitzförmigen Lumen führt, gekennzeichnet2. Diese Tumoren können schwierig von einer kribriformen PIN zu unterscheiden sein2. Kriterien, die für ein Karzinom sprechen umfassen sowohl Rücken-an-Rücken stehende oder unregelmäßigen Drüsen als auch umfangreiche Comedonekrosen und Kernatypien in den Drüsen2. Sowohl die kribriforme PIN und als auch das kribriforme duktale Adenokarzinom haben eine erhaltene Basalzellschicht2. Ein Vergleich zwischen gleichaltrigen Männern mit azinären und duktalen Tumoren zeigen, dass letztere sich vermehrt mit obstruktiven Symptomen oder Hämaturie präsentieren2. Nur ein kleiner Anteil der duktalen Adenokarzinome reagiert gut auf eine Hormontherapie2. Obwohl einige der Tumoren einen recht indolenten Verlauf haben, sind die meisten zumeist aggressiv mit einen Gleason-Score von 82. Die duktalen Adenokarzinome der Prostata sind zum Zeitpunkt der radikalern Prostatektomie meist recht groß und haben ein hohes Risiko für einen frühen postoperativen Relaps2. |
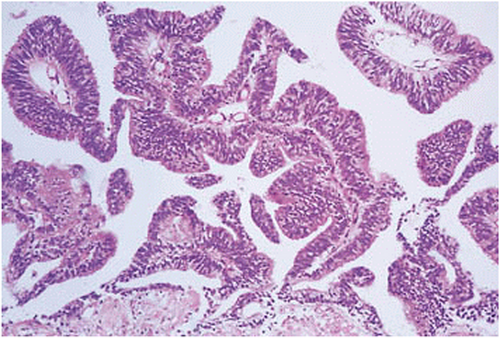
Abb. 619: Intraduktales Prostatakarzinom mit Ausbildung von Papillen. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
|
| Plattenepithel-CA der Prostata | Reine Plattenepithelkarzinome der Prostata sind sehr selten (0,5% der Prostata-Tumoren) und gehen mit einem schlechten Überleben einher2. Diese Tumoren führen zu osteolytischen Metastasen, sprechen nicht auf eine Hormontherapie an und entwickeln keine Serum- PSA Erhöhung bei metastatischer Ausbreitung2. Eine plattenepitheliale Differenzierung ist sowohl in den primären als auch in den metastatischen Absiedlungen der Tumoren zu erkennen2. Diese Tumoren werden häufiger bei Männern gesehen, die eine Hormontherapie erhalten haben, sie können aber auch in Abwesenheit der vorherigen Behandlung in Erscheinung treten2. Die plattenepitheliale Komponente ist in diesen Tumoren PSA positiv2. |
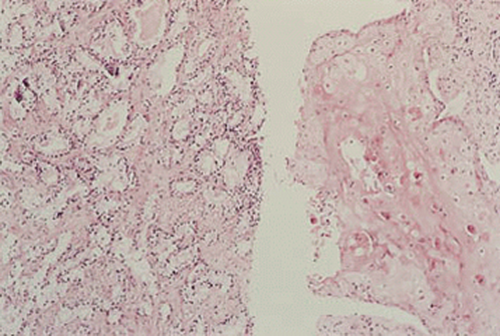
Abb. 620: Erkennbar ist ein plattenepithelial differenziertes Karzinom der Prostata (rechte Bildhälfte) (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
Grading
Um eine prognostische Einschätzung eines Tumors treffen zu können, muss die große Gruppe der azinären („gewöhnlichen“) Prostatakarzinome mithilfe des „grading“ und „staging“ unterteilt werden3. Für das Grading des gewöhnlichen Prostatakarzinoms hat sich weltweit das Gleason-Grading (Gleason-Score) entsprechend der Konsensuskonferenz der WHO von 2002 durchgesetzt13. Daneben ist das Grading nach Mostofi/WHO und in Deutschland das Grading des pathologisch-urologischen Arbeitskreises nach Helpap etabliert1. Letzteres ist jedoch nicht international gebräuchlich1. Seit 2005 findet auch ein modifiziertes Gleason-Grading Anwendung, das auf einer internationalen Konsensuskonferenz festgelegt wurde und in Deutschland als modifiziertes Gleason-Grading nach Helpap bekannt ist1. Ein Grading nach WHO ist v. a. dann empfehlenswert, wenn wenig Tumormaterial zur Verfügung steht1. Hier richtet sich das Grading nach dem am schlechtesten differenzierten Tumorabschnitt3.
Der Gleason Score basiert auf dem Drüsen-Muster (ohne Zytologie) des Tumors und kann bereits bei relativ geringer Vergrößerung bestimmt werden2. Hier wird sowohl das primär vorherrschende als auch das am zweithäufigsten vorliegende architektonische Muster identifiziert und einem Punktesystem (von 1 bis 5) zugeordnet wobei 1 für die am stärksten differenzierten und 5 für besonders undifferenzierte Drüsen steht211. Bedingung für die Aufnahme eines sekundären Gleason-Musters in den Score war ein entsprechender Tumoranteil von mindestens 5%11. Wenn ein Tumor ein einheitliches histologisches Muster aufweist, dann wird diese Punktzahl zweimal vergeben211. Der Gleason-Score reicht von 2 (1 + 1 = 2), mit gut differenzierten Drüsen bis 10 (5 + 5 = 10) einhergehend mit einer völlig undifferenzierten Drüsenarchitektur2.
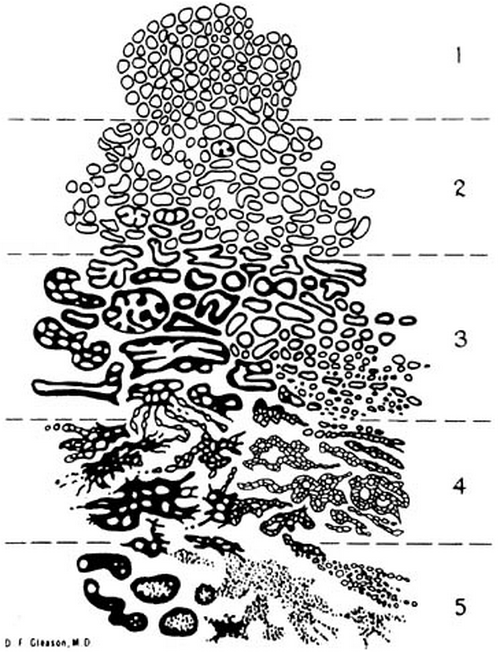
Abb. 622: Schematische Zeichnung des Gleason Grading Systems. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
Ein Tumor, der überwiegend ein Gleason Score von 3 hat, aber noch über eine geringe Menge an Gleason Score 5 verfügt, erhält einen kombinierten Gleason-Score von 8 (3 + 5 = 8)2. Gleiches gilt für Tumoren, die überwiegend Gleason Score 5 mit einer geringeren Menge an Gleason Score 3 (5 + 3 = 8) enthalten2. So kann der Gleason-Score in der Form einer einfachen mathematischen Gleichung auf einen Blick die wahre Natur des Tumors darstellen2. Auch im Rahmen einer Nadel Biopsie, also wenn wenig Gewebe vorliegt kann der Gleason Score angewendet werden211. Pan et al. hatten 2000 erstmals gezeigt, dass kleine, wenig differenzierte Prostatakarzinomanteile, die bei Verwendung des traditionellen Gleason-Gradings nicht als primärer oder sekundärer Gleason-Grad in den Score eingeflossen sind, von ausgeprägter prognostischer Relevanz sind11. Die Autoren schlugen deswegen die Verwendung eines Tertiärgrades vor, wobei der höchste Gleason-Grad, der aufgrund quantitativer Kriterien nicht als primärer oder sekundärer Gleason-Grad erfasst wird, als Tertiärgrad definiert wurde11. Ein kleiner Gleason-4-Anteil von ca. 2% führt so in einem sonst aus Gleason-3-Muster bestehendem Tumor zu der Beurteilung Gleason 3+3=6 (Tertiärgrad Gleason 4)11. Die klinische Relevanz des tertiären Gleason-Grades konnte mittlerweile von zahlreichen Publikationen untermauert werden11. Bei sorgfältiger Aufarbeitung der Prostatektomiepräparate findet sich in ca. 20–30% der operierten Prostatakarzinome ein tertiärer Gleason-Grad11. Er soll jedoch nur bei Prostatektomien oder TURP vergeben werden11. Um prognostisch ungünstige Tumoranteile auch in Prostatastanzen zu erfassen, wurde empfohlen, in Stanzbiopsien nicht mehr die beiden quantitativ dominierenden Gleason-Muster für die Bestimmung des Gleason-Scores zu verwenden, sondern das ausgedehnteste und aggressivste Muster zu verwenden1115. Ein Tumor mit 60% Gleason-3-, 35% Gleason-4- und 5% Gleason-5-Anteilen würde somit nach aktuellen Kriterien zum Gleason 3+5 (anstatt Gleason 3+4) klassifiziert werden11.
| Grad | Drüsenarchitektur | Bildbeispiel |
|---|---|---|
| 1 | Erkennbar ist ein umschriebener Tumorherd mit dicht zusammenliegenden gut voneinander abgrenzbaren gleichförmigen rund bis ovalären mittelgroßen Drüsenazini211. | 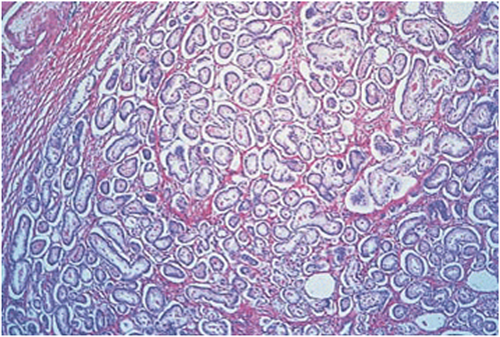
Abb. 623: Prostatakarzinom mit einem Gleason Score von 1. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
| 2 | Auch in diesem histologischen Bild ist noch ein gut umschriebener Tumor erkennbar211. Am Rand des Tumorknotens kann jedoch eine minimale Ausdehnung von neoplastischen Drüsen in das umgebende nichtneoplastische Prostatagewebe vorliegen2. Die Drüsen sind noch einzeln, jedoch sind sie lockerer angeordnet und nicht ganz so einheitlich wie bei Grad 1211. | 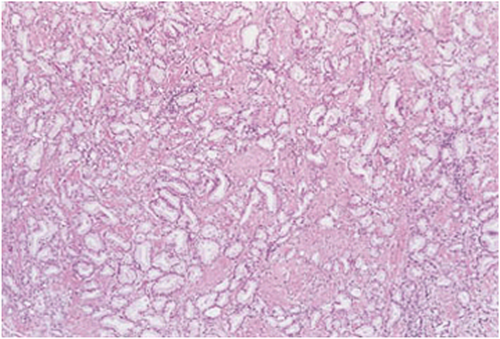
Abb. 624: Prostatakarzinom mit einem Gleasonscore von 2. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
| 3 | Hier infiltriert der Tumor bereits in die nichtneoplastische Prostata211. Die Drüsen variieren nun stark in Form und Größe211. Viele der Drüsen sind kleiner als jene in den obengenannten Graden211. Solange man vor seinem geistigen Auge noch einen Kreis um die wohlgeformten einzelnen Drüsen zeichnen kann, spricht man vom Gleason Grad 32. | 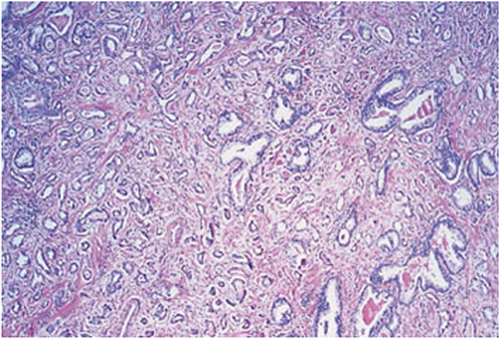
Abb. 625: Prostatakarzinom mit einem Gleasonscore von 3
|
| 4 | Verschmolzene mikroazinäre Drüsen, welche nicht mehr voneinander abgrenzbarsind2, mit schlechtentwickelten Drüsenlumina11. Daneben große kribriformeDrüsen mit unregelmäßiger Randkontur11. | 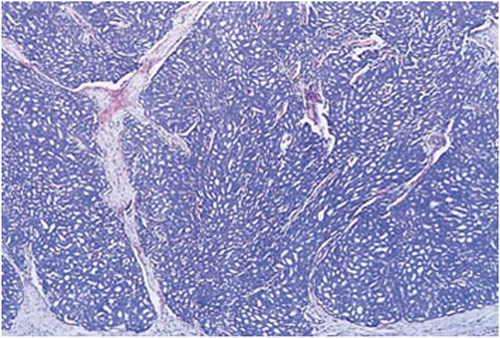
Abb. 626: Prostatakarzinom mit einem Gleasonscore von 4. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
| 5 | Eine glanduläre Differenzierung ist hier nicht mehr erkennbar2. Es finden sich entweder solide Zellmassen, oder einzelne infiltrierende Zellen2. Kribriforme Drüsen mit zentralen Nekrosen (Komedonekrosen) zählen ebenfalls zum Muster 5 (hier nicht dargestellt)11. | 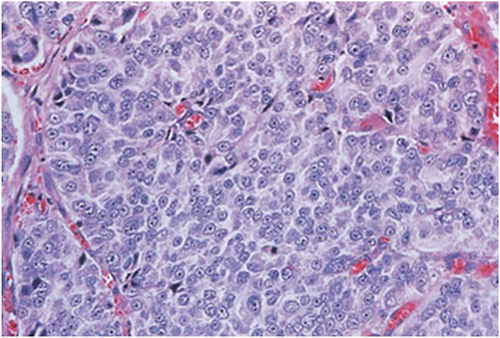
Abb. 627: Prostatakarzinom mit einem Gleasonscore von 5. (Quelle: Sternberg – The Prostate and Seminal Vesicles)
|
Das Gleason-Grading-System ist eines der stärkeren prognostischen Indikatoren beim Prostatakarzinom2. Es korreliert mit allen wichtigen pathologischen Parametern wie der Prognose nach RPE und mit dem Outcome nach Strahlentherapie2. Das Grading kann entscheidend sein, ob eine definitive Behandlung folgt (watchful waiting vs. Operation oder Bestrahlung), welche Art der Behandlung erfolgt (Operation vs. Strahlentherapie), und auch bezüglich Entscheidungen innerhalb einer bestimmten Therapie (Brachytherapie vs. externe Strahlentherapie)2. Weiterhin korreliert der Score nach RPE mit dem pathologischen Staging und dem postoperativen Verlauf2. Selbst innerhalb der einzelnen Gleason-Scores variiert die Prognose2. Ein Score von 7 kann sich zum einen aus 4 + 3 = 7 einhergehend mit einer schlechteren Prognose, oder aus 3 + 4 = 7, einhergehend mit einer besseren Prognose zusammen setzen2. Tumoren mit einen Score von 2 bis 4 neigen dazu, in der Übergangszone (periurethrale Region), wo die Tumoren in der Regel ziemlich klein und der Nadelbiopsie nicht immer zugängig sind, zu liegen2. In Proben nach RPE, ist es nicht ungewöhnlich, einen Gleason-Score von 5 bis 7 Tumor in der peripheren Zone und einen Gleason-Score von 2 bis 4 in der Übergangszone zu haben2.
Ein Gleason-Score soll nicht erstellt werden bei1:
- konservativ vortherapiertem gewöhnlichem Karzinom;
- adenosquamösem und Plattenepithelkarzinom;
- Urothelkarzinom;
- Basalzellkarzinom;
- kleinzelligem Karzinom
Regressionsgrading: Zeichen der Regression des Prostatakarzinoms nach hormonablativer Therapie oder Bestrahlung umfassen Zytoplasmavakuolisierung und Kernpyknosen1. Zur Identifizierung regressiv veränderter Tumorzellen eignet sich die immunhistochemische PSA -Färbung1. Dhom und Degro haben einen Vorschlag zur Quantifizierung der Tumorregression in „gering, mäßig und stark“ erarbeitet; es existiert jedoch kein internationaler Standard für ein Regressionsgrading des Prostatakarzinoms1.
Staging
Das am häufigsten verwendete klinische Staging-System für das Adenokarzinom der Prostata ist das TNM –System2. Die Stadien T1a und T1b sind klinisch unauffällige Tumore, die entweder durch Biopsien via TURP oder Enukleation im Rahmen einer BPH entdeckt und entfernt werden2. Das Stadium T1c bezieht sich auf nicht tastbare Tumoren in der Nadelbiopsie, welche in der Regel aufgrund einer abnormen Serum-PSA -Bestimmung durchgeführt wurde2. Stadium T2 ist als auf die Prostata begrenzter tastbarer Tumor definiert1. Eine Subkategorisierung erfolgt weiter in die Stufen T2a und T2b, je nachdem, ob ein unilateraler oder bilateraler Tumor vorliegt2. Das Stadium T3 stellt einen Tumor dar, der bereits über die Organgrenzen hinausgeht2. Auch hier gibt es eine Subklassifikation in T3a und T3b, je nachdem ob ein extraprostatischer Tumor ohne oder mit Invasion der Samenblase vorliegt2. N1 repräsentiert das Vorhandensein von Metastasen in regionalen Lymphknoten während Fernmetastasen durch M1 repräsentiert werden2. Zusammenfassend werden damit die Stadien T1-2 N0 M0 unter der Bezeichnung lokal begrenztes Prostatakarzinom, die Stadien T3-4 N0 M0 unter der Bezeichnung lokal fortgeschrittenes Prostatakarzinom und die Stadien N1-3 und/oder M1 als fortgeschrittenes bzw. metastasiertes Prostatakarzinom bezeichnet16.
Wie bei allen Staging-Systemen, gibt es eine Unterscheidung zwischen klinischen und pathologischen Stadien2. Zum Beispiel kann ein Patient mit einem klinischen Stadium T2b, dessen Tumor im Rahmen der rektalen Untersuchung auf die Prostata zu begrenzt zu sein scheint, auf T3 hochgestuft werden, wenn im Rahmen der histologischen Aufarbeitung des Prostatektomiepräparates Tumorformationen auch außerhalb der Drüse nachweisbar sind2. Von bilateralen Prostatatumoren spricht man wenn2:
1. ein großer Tumorknoten mit kontralateralen kleinen, low grade, klinisch unbedeutende Tumoren vorliegt
2. beidseitig erhebliche Tumorknoten, nachweisbar sind
3. ein einziger, großer, konfluierender Tumor vorliegt, der beide Seiten der Drüse einnimmt
Zur Bestimmung der klinischen T-Kategorie soll der DRU -Befund herangezogen werden1. Desweiteren sollten Befunde von bereits durchgeführten bildgebenden Verfahren berücksichtigt werden1.
Während bei Patienten mit der Tumorkategorie cT1 und low-risk-Parametern keine bildgebenden Untersuchungen zum Staging (Sonographie, MRT, PET CT) nötig sind, sollten Patienten mit einem Gleason-Score von ≥ 8 oder einer Kategorie cT3/4 vor der Entscheidung über eine therapeutische Maßnahme abhängig von der Fragestellung eine MRT – oder CT- Untersuchung der Beckenorgane erhalten1. Bei Patienten mit einem histologisch gesicherten Prostatakarzinom und einem PSA -Wert von > 10 ng/ml oder einem Gleason-Score ≥ 8 oder einer T-Kategorie cT3/4 oder Knochenschmerzen oder ein unklarer Anstieg bzw. Erhöhung der alkalischen Phosphatase hat eine Skelettszintigraphie zu erfolgen16. In der Metaanalyse von Abuzallouf 2004 wurden insgesamt 23 Studien zur Knochenszintigraphie bei Patienten mit neu diagnostiziertem, unbehandeltem Prostatakarzinom analysiert1. Dabei wurde im Besonderen die Wahrscheinlichkeit für das Vorliegen von Knochenmetastasen in Abhängigkeit vom PSA -Wert, der T-Kategorie und dem Gleason-Score ermittelt1. Es gilt als gesichert, dass bei einem Gleason Score >7 eine erhöhte Prävalenz an Knochenmetastasen besteht1.
Die Ergebnisse aus der systematischen Aufarbeitung der Literatur – meist retrospektive Fallserien – zeigen folgende Wahrscheinlichkeiten für das Vorliegen von Knochenmetastasen abhängig vom PSA -Wert1:
- PSA<10 ng/ml: 2,3 % (KI: 1,7-3,0 %)
- PSA 10-19,9 ng/ml: 6 % (KI: 4,6-7,6 %)
- PSA 20-49,9 ng/ml: 15,9 % (KI: 12,9-19,2 %)
- PSA 50-99,9 ng/ml: 39,2 % (KI: 29,0-41,8 %)
- PSA>100 ng/ml: 74,9 % (KI: 70,8-78,7 %)
Sowohl die Tumorausdehnung im Stanzpräparat als auch die Zahl der positiven Stanzen wird benötigt, um die Möglichkeit einer Active-Surveillance-Strategie prüfen zu können1.
Laut einer Metaanalyse von Abuzallouf et al. von 2004 steigt die Prävalenz einer histologisch bestätigten N+-Kategorie bei Gleason > 7 auf 22,8 % und bei T3/4 auf 25,7 % an16. Unter den Schnittbilduntersuchungsmodalitäten gelten die MRT und die CT als vergleichbar für das Lymphknotenstaging16. Aufgrund der deutlich besseren Beurteilbarkeit des Lokalbefundes sollte allerdings bevorzugt die MRT durchgeführt werden6.
Differentialdiagnose
| Histologie | |
|---|---|
| Atrophische Drüsen | Ein Kennzeichen der verkleinerten Drüsen sind große Lumina, welche von Zellen umgeben werden, die eine hohe Kern-Plasma-Relation aufweisen und so zu einem sehr basophilen Aussehen der Drüsen führen2. Findet sich eine erhöhte Anzahl dieser Drüsen, spricht man auch von einer Prostatahyperplasie2. Trotz ihres atrophischen Aussehens können diese kleinen Drüsen eine erhöhte Proliferationsrate haben2. Dazwischen können aber auch dilatierte Drüsen zu liegen kommen, die von fibrotischem Stroma umgeben sind2. Im Gegensatz dazu zeigen Karzinomdrüsen schon bei geringer Vergrößerung ein meist blasses Zellbild, mit reichlich Zytoplasma und basal gelegenen Kernen2. Die hohe Kern-Plasma-Relation in atrophischen Drüsen findet sich in der Regel nur in schlecht differenzierten Adenokarzinomen2. Kleine Drüsen mit partieller Atrophie können eng beieinander liegen und so ein unorganisiertes infiltratives Aussehen imitieren und damit fälschlicherweise als Karzinom imponieren2. |
| Adenose | Sie ist bei geringer Vergrößerung durch zahlreiche eng anliegende, kleine, blass gefärbte Drüsen gekennzeichnet, die einem Low-grade-Adenokarzinom der Prostata ähneln können2. Sowohl die Adenose als auch das Low-grade-Karzinom können aus nichtinfiltrativen Drüsenformationen bestehen2. Bei der Adenose neigen die Drüsen jedoch mehr zu einer lobulären Konfiguration2. Im Gegensatz dazu sind die Drüsen in Low-grade-Karzinomen zufällig angeordnet2. Weiterhin gibt es bei der Adenose einen allmählichen Übergang zwischen den kleinen Drüsen mit blass bis klaren Zytoplasma und den angrenzenden benignen Drüsen; es finden sich aber auch einige Merkmale der benignen Drüsen wie Verzweigungen, größere, unregelmäßige Drüsenformationen, und papilläre Einfaltungen2. Typischerweise sind die Nucleoli bei der Adenose eher unscheinbar, obgleich sie gelegentlich auch fokal prominent in Erscheinung treten können2. Die Verwendung von Basalzell-Marker kann helfen, Diagnose der Adenose zu stellen, vor allem wenn atypische Merkmale vorliegen2. Innerhalb eines Adenoseknotens zeigen zwischen 10% und 100% (im Mittel 2/3) der Drüsen eine positive Färbung für 34βe122. Die Färbung kann innerhalb einer positiven Drüse lückenhaft erscheinen, manchmal finden sich auch nur wenige abgeflachte immunreaktive Basalzellen2.Merkmale, die eine Adenose nicht von einem Low-grade-Adenokarzinom unterscheiden sind2:
|
| Sklerosierende Adenose | Eine Variante des Adenose, die mit mittel-bis hochgradigen Adenokarzinomen der Prostata verwechselt werden kann, ist die sklerosierende Adenose der Prostata2. Sie besteht aus einem kleinen, relativ lokalisierten Fokus von Drüsen, die der gewöhnlichen Adenose ähneln2. Die Nukleoli sind zum Teil prominent und einige der Drüsen können von einem dicken hyalinen Basalmembran-ähnlichen Mantel umgeben sein2. Zwischen den Drüsen und einzelnen Epithelzellen, findet sich ein spindelzellartiges Stroma2. Die Immunhistochemie mit Aktin und S100 zeigt, dass eine myoepitheliale Differenzierung vorliegt. |
| PIN | Die PIN besteht aus gutartigen Prostataacini und Drüsengängen, die zytologisch durch atypische Zellen ausgekleidet werden bei erhaltener Basalzellschicht11, und kann in eine Low-und High-Grade-PIN unterteilt werden2. Diese Unterscheidung basiert auf dem Nachweis prominenter Nukleoli bei der High-Grade-PIN211. Gelegentlich kann die Diagnose auch in Abwesenheit der prominenten Nukleoli erfolgen, wenn eine deutliche Kernpleomorphie vorliegt2. Obgleich die High-grade PIN durch Kernatypien gekennzeichnet ist, finden sich häufig auch architektonische Auffälligkeiten2. Schon bei geringer Vergrößerung können die Drüsen, die durch etwas Stroma getrennt sind und architektonisch eher unauffällig wirken, durchaus eine High-Grade-PIN imitieren2. Sie ähneln benignen Drüsen, sind groß, verzweigt, und haben papilläre luminale Auffältelungen2. Bei geringer Vergrößerung, erscheinen die Drüsen basophil aufgrund vergrößerter und überlappender Zellkerne, Hyperchromasie, amphophilen Zytoplasma und epithelialer Hyperplasie2. Die früheste Form der High-Grade-PIN ist durch Kernatypien innerhalb der Epithelien ohne epitheliale Hyperplasie gekennzeichnet2. Die Grenze zwischen atypischen und normalen Kerne kann häufig abrupt erfolgen und die Basalzellschicht kann, muss aber nicht sichtbar sein und2. In der Immunhistochemie zeigt die High-Grade PIN typischerweise eine deutlich fragmentierte und strikt einreihige Basalzellschicht13. Ungewöhnliche Subtypen der High-Grade-PIN umfassen PIN mit Siegelringzell-Eigenschaften, die kleinzellige neuroendokrine PIN, PIN mit muzinösen Merkmalen, die schaumzellige PIN und die PIN mit invertierten Zellkernen2. Die PIN muss von infiltrierenden Karzinomen als auch von verschiedenen benignen Erkrankungen abgegrenzt werden2. Zytologisch lässt sich die High-Grade-PIN nicht vom Azinuszellkarzinom unterscheiden2. Im Gegensatz zur PIN, sind duktale Adenokarzinome in vielen Fällen zentral gelegen, haben papilläre Formationen, zeigen ein kribriformes Wachstumsmuster mit vielen Komedonekrosen, und mehr diffuse zytologischen Atypien2. Die kribriforme PIN kann nicht von einem kribriformen azinären Karzinom unterschieden werden2. Ein Karzinom sollte nur dann diagnostiziert werden, wenn die kribriformen Drüsen Rücken an Rücken stehen, oder wenn sich viele solcher Drüsen in der Immunhistologie nicht anfärben lassen2. Es gibt Hinweise, die zeigen, dass die High-Grade-PIN Vorläuferläsionen für zumindest einen Teil der Prostatakarzinome sind2. Mehrere Studien konnten zeigen, dass eine High-Grade-PIN häufig in der peripheren Zone der Prostata zu liegen kommt und damit dem Ursprungsort der meisten Adenokarzinome entspricht2. Weiterhin konnte nachgewiesen werden, dass die High-Grade-PIN eher mit mittel bis schlecht differenzierten Tumoren einhergeht2. Aus diesen Gründen sollte bei allen Patienten, die eine High-Grade PIN in der Biopsie aufweisen, eine Rebiopsie der gesamten Prostata erfolgen, um ein Karzinom auszuschließen211. |
| ASAP | Während die PIN eine eindeutig definierte Karzinomvorstufen darstellt, steht die ASAP nicht für eine bestimmte Entität11. Sie fällt unter die Befunde, die karzinomverdächtig sind, aber für eine eindeutige Karzinomdiagnose quantitativ und/ oder qualitativ nicht ausreichen11. Studien ergeben in Nachfolgebiopsien bei ASAP ein Karzinom in 29–75% (Mittel: 43%)11. |
| AAH | Sie ist der Prototyp einer benignen, hellzelligen Prostataläsion, die man mit dem Prostatakarzinom Gleason-Grad 1 und 2 verwechseln kann13. Pathologische Sekretprodukte (eosinophiles Sekret, Kristalloide) finden sich, wenn auch in unterschiedlicher Häufigkeit, in beiden Läsionen13. In der AAH erkennt man immunhistochemisch mit Basalzellmarkern (34βE12, P63) meist im Zentrum der Läsion vorbestehende und hyperplastische Drüsen13. Zur Peripherie hin werden die Drüsen zunehmend kleiner und verlieren ihre Basalzelldifferenzierung13. Zytoloisch unterscheiden sich die suspekten mikroazinären Drüsenproliferate in der Peripherie nicht signifikant von den zweireihigen Drüsen mit noch nachweisbarer Basalzelldifferenzierung13. AMACR ist meist negativ oder schwach positiv13. |
| Benigne hellzelllige mikroglanduläre Läsionen vom Typ AAH | Sie werden gelegentlich auch in Stanzbiopsien erfasst und können mit einem primären Gleason-Grad 2 und 3 B verwechselt werden13. Bei hellzelligen mikroglandulären Läsionen unklarer Dignität liefert die Darstellung vorbestehender, zweireihiger Drüsen mit Hilfe der Basalzellmarker die wichtigsten Informationen13. Gegen ein Prostatakarzinom sprechen die folgenden Kriterien13:
|
| Cowper-Drüsen | Sie sind eine seltene Differenzialdiagnose des primären Gleason-Grades 1 in Stanzbiopsien13. Typisch für Cowper-Drüsen sind dichtgelagerte, hellzellige und einheitliche Drüsen (wie Gleason- Grad 1) in Assoziation mit kleinen duktalen Strukturen (Ausführungsgänge) und quergestreifter Muskulatur13. Die hellzellige Komponente zeigt immunhistochemisch keine Basalzelldifferenzierung und ist PSA -negativ oder grenzwertig positiv13. Der wichtigste Marker ist die PAS -Reaktion13. (positiv in Cowper-Drüsen und negativ im Prostatakarzinom) |
Screening
Ziel der Früherkennung ist es, organbegrenzte aggressive Tumoren bei asymptomatischen Männern mit einer mutmaßlichen Mindestlebenserwartung von mindestens 10 Jahren zu erkennen1. Da der weitaus größte Teil der Patienten mit einem Prostatakarzinom an einer anderen Ursache verstirbt, ist eine signifikante Senkung der allgemeinen Mortalität aufgrund eines Screenings bzw. einer Früherkennungsuntersuchung auf Prostatakrebs auch bei ggf. erfolgreicher Senkung der prostatakarzinomspezifischen Mortalität nicht zu erwarten1. Es sei anzumerken, dass durch das Screening auch Karzinome entdeckt werden, die ohne Früherkennung oder Screening nie symptomatisch geworden wären1. Damit führt die Suche nach noch heilbaren Prostatakarzinomen also auch zu einer unnötigen Diagnostik und Therapie und den damit verbundenen Nebenwirkungen1.
Bei Wunsch auf ein Screening besteht eine Aufklärungspflicht über die Möglichkeit einer PSA -gesteuerten Früherkennung des Prostatakarzinoms1. Hierbei muss darauf hingewiesen werden, dass anhand eines PSA -Testergebnisses nur das Risiko für das Vorliegen eines Tumors vorher gesagt werden kann1. Weiterhin sollen die Patienten darüber informiert werden, dass die Wahrscheinlichkeit an einem Prostatakarzinom zu versterben in Deutschland etwa 3 % beträgt und eine Früherkennung diese Wahrscheinlichkeit bei Annahme der positivsten Ergebnisse auf 2,4 % bis maximal etwa 1,8 % senken kann1.
Die alleinige DRU wird zur Früherkennung als nicht ausreichend angesehen1. Primäres Verfahren ist daher die PSA -Wert Bestimmung, weil ihre Sensitivität höher ist als die Sensitivität anderer Verfahren110. Die Kombination aus PSA -Wert und DRU erhöht die Spezifität der Prostatakarzinom-Erkennung110. Jeder PSA -Wert, der zur weiterer, ggf. invasiven Diagnostik (Biopsie) führt, bedarf vorher der Kontrolle, wenn seine Plausibilität nicht durch den bekannten Verlauf vorangegangener PSA -Messungen ausreichend belegt ist1. Die Kontrolle der PSA -Werte sollte nach 6-8 Wochen erfolgen1. Derzeit wird ein PSA -Wert über 4 ng/ml als pathologisch angesehen12. Intermediär erhöhte PSA -Werte zwischen 4 und 10 ng/ml können aber auch durch benigne Veränderungen hervorgerufen werden12. Auf der anderen Seite schließen niedrige PSA -Serumwerte das Vorhandensein eines Prostatakarzinoms nicht vollständig aus12. Bei erstmaliger Früherkennungsuntersuchung soll bei einem PSA -Wert ≥4 ng/ml eine bioptische Abklärung in Erwägung gezogen werden10. Im Verlauf soll die Biopsieindikation individuell an der PSA -Dynamik festgemacht werden, wobei sich der Grenzwert zwischen 0,35 und 0,75 ng/ml/Jahr bewegen sollte10.
Folgende Faktoren auf Seiten des Patienten können den PSA Wert beeinflussen: noduläre Hyperplasie2, Harnverhalt, HWI ,vorherige Manipulationen an der Prostata (z. B. Biopsie2, DRU, Katheterismus, Koloskopie) oder die akute Prostatitis12. Ob Radfahren oder Ejakulationen den PSA Wert bedeutsam verändern, wird in der Literatur widersprüchlich beurteilt1. Wahrscheinlich wird der Gesamt-PSA Wert hierdurch nur marginal, der freie PSA Wert etwas stärker beeinflusst1. Im Zweifelsfall kann eine Kontrollmessung nach einigen Tagen ohne die genannten Einflussfaktoren Klarheit schaffen1. Auch das Prostatavolumen kann einen Einfluss auf die Höhe des PSA Wertes haben1. Vor allem die Vergrößerung der Prostata kann zum Anstieg des PSA Wertes führen12. Dieser Zusammenhang wird auch als PSA Dichte bezeichnet2. Das Serum PSA Wert wird dabei durch das Volumen der Prostata geteilt, welches mit Hilfe der TRUS berechnet wird2. So erhält man den PSA pro Gramm Gewebe2. Da Karzinome mehr PSA pro Gramm Gewebe produzieren als dies bei einer BPH der Fall ist, ist ein hoher PSA Wert ein besserer Indikator für einen Tumor als die Verwendung des unkorrigierten PSA Werts2. Die Prostatagrößenbestimmung kann vor allem zur Vermeidung unnötiger Biopsien hilfreich sein1. Ihre Größe soll deshalb bei der Interpretation des PSA Werts berücksichtigt werden1. Steht darüber hinaus eine PSA Verlaufskontrolle über viele Jahre zur Verfügung, spricht das Fehlen eines PSA Anstieges zusätzlich für eine PSA Erhöhung auf Grund des erhöhten Prostatavolumens112. Weiterhin kann die Bestimmung des freien PSA hilfreich sein, da der Anteil des freien PSA mit dem Volumen einer benignen Prostatavergrößerung steigt1212. Männer mit einem hohen Quotienten aus freiem- und Gesamt-PSA (ca. > 0,24, Grenzwert ist abhängig vom Messverfahren) haben ein eher geringes Risiko für das Vorliegen eines klinisch relevanten Prostatakarzinoms1.
Liegt bei leicht erhöhtem Gesamt-PSA Wert eine Befundkonstellation vor, die für ein nur geringes Prostatakarzinomrisiko spricht, sollte im Gespräch mit dem Patienten neben einer Prostatabiopsie auch die Möglichkeit einer weiteren PSA Verlaufsbeobachtung erörtert werden1. Eine weitere Screening-Technik, ist die Bestimmung der PSA Geschwindigkeit, wo die Änderung des PSA pro Zeiteinheit gemessen wird2.
In etwa 50% der organbegrenzten Tumoren und 33% der Tumoren mit extraprostatischem Wachstum sind mit normalen Serum-PSA Werten verbunden1.
Klinik
Die überwiegend in der peripheren Zone der Prostata entstehenden Karzinome sind zunächst meist symptomlos12. Unspezifische Symptome, wie z. B. Unterbauchschmerzen, Dysurie oder Hämospermie können auftreten, finden sich aber ebenso bei den häufiger vorhandenen gutartigen Erkrankungen der Prostata, wie der BPH und der Prostatatitis12. Sypmtome können aber auch erst im fortgeschrittenen Stadium entstehen, wenn die Patienten durch ossäre Metastasen Schmerzen entwickeln.
Diagnostik
- Labor: Die Verdachtsdiagnose bzw. die Risikoabschätzung für ein Prostatakarzinom ergibt sich heute primär durch Bestimmung der Serumkonzentration des PSA -Werts (siehe Abschnitt Screening)6. Beim PSA handelt es sich um eine Serin-Protease, die physiologischerweise für die Verflüssigung des Ejakulats zuständig ist15. Jede Zerstörung der normalen Prostatastruktur (Entzündung, Biopsie) ermöglicht größeren PSA Mengen die Diffusion ins Serum15. Die Tumorzelle produziert an und für sich weniger PSA als die normale Zelle, für die hohen Serum PSA Konzentrationen sind jedoch die höhere Zahl PSA -produzierender Zellen und die Zerstörung der ursprünglichen Prostatastruktur verantwortlich15.
Das PCA3 wird in Prostatakarzinomgewebe im Vergleich zu gutartigem Prostatagewebe deutlich überexprimiert10. Nach transrektaler Prostatamassage wird die PCA3-Konzentration im Urin bestimmt und durch Normalisierung auf den PSA -Wert ein Score gebildet10. Das Testsystem besitzt eine vergleichbare Sensitivität und eine höhere Spezifität als der PSA -Wert alleine10. - DRU: Sie steht als einfache und kostengünstige Untersuchung meistens am Anfang der Prostatadiagnostik, z. B. im Rahmen der Früherkennungsuntersuchung6. So wird durch einen auffälligen Tastbefund bei der DRU der Verdacht auf ein Prostatakarzinom unabhängig vom PSA -Wert begründet16 und sollte eine weiterführende Diagnostik (z.B.: eine Biopsie) nach sich ziehen6. Trotz geringer Sensitivität weist die DRU eine relativ hohe Spezifität und einen sehr hohen negativen prädiktiven Wert auf1. Eine Metaanalyse ergab eine Sensitivität von 59 % (51-67 %), eine Spezifität von 94 % (91-96 %), einen positiven prädiktiven Wert von 28 % (20-36 %) und einen negativen prädiktiven Wert von 99 % (98-99 %)16.
- 2D TRUS: Mit Hilfe des B-mode-TRUS kann eine gute Abgrenzung der Prostata vom umliegenden Gewebe wie Rektum, neurovaskulären Bündel, Venenplexus und Fettgewebe ermöglicht werden5. Dabei lässt sich die periphere Zone (P-Zone) gut von den zentralen Drüsenanteilen (Transitional- und zentrale Zone) abgrenzen5. Asymmetrien der Prostata, gestaute Samenblasen und ein hypoechogenes Echobinnenmuster sind malignitätsverdächtig5. Die Wahrscheinlichkeit, dass ein solches hypoechogenes Areal einem Prostatakarzinom entspricht, variiert zwischen 17 und 57%512. Auch heben sich etwa 50% der nicht palpablen Karzinome mit einer Größe von mehr als 1 cm nicht von ihrer Umgebung ab12. Die Sensitivität des B-mode-TRUS zur Detektion einer Neoplasie wird in der Literatur zwischen 44 und 90%, die korrespondierende Spezifität mit 30–74%56, der PPV mit 45% und der NPV mit 72% angegeben6. Weiterhin lässt sich mit dem einfachen TRUS das Prostatavolumen bestimmen, was hilfreich bei der Bewertung des PSA-Wertes sein kann16. Sie spielt aber auch eine wichtige Rolle bei der Steuerung der Stanzbiopsie612.
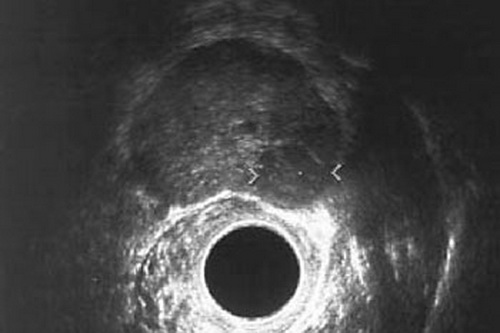
Abb. 631: TRUS Aufnahme
Oberhalb der Sonde (schwarzer Kreis) liegt die Prostata (dunkles Gebilde), darin ein echoarmer Herd, vermutlich ein Prostatakarzinom (dunkler Kreis zwischen den hellen Mess-Pfeilen). Quelle: http://www.prostata.de
- CD- und PD-TRUS: Da die Angio- und Vaskulogenese ein elementarer Baustein in der Tumorgenese und –progression darstellen, ist es ein Ziel der Frühdiagnostik mit Hilfe der farbcodierten Dopplersonografie eben diese Auffälligkeiten frühzeitig darzustellen5. Hierbei werden zu dem konventionellen B-mode-TRUS veränderte Blutflusseigenschaften addiert und diese durch die Dopplersonographie sichtbar gemacht5. Rifkin et al. haben in ihrer Arbeit verschiedene pathologische Flussmuster kategorisiert: erhöhte Flussrate innerhalb der Läsion – erhöhte Flussrate um die Läsion herum – asymmetrischer Flow im Vergleich zum umliegenden Normalgewebe5. Die klinischen Daten zeigen, dass die farbkodierten Ultraschalltechniken sowohl mit dem Tumorstadium als auch mit dem Differenzierungsgrad der Prostatakarzinome korrelieren5. Allerdings schließt ein unauffälliger Befund im B-mode-TRUS bzw. im CD-/PD-TRUS die Notwendigkeit einer Biopsie nicht aus, sodass weiterhin eine Prostatastanzbiopsie zu empfehlen ist5. Die Testgüteparameter im Farbdopplermodus unterschieden sich von jeder der 2D TRUS nur geringfügig6.
- 3D-TRUS: Der 3-dimensionale Ultraschall bietet einige Vorteile gegenüber dem 2-dimensionalen Verfahren5. Mit seiner Hilfe lassen sich hochauflösende Bilder generieren, die die Prostata in allen 3 Dimensionen simultan (sagittal, transversal und koronar) darstellen können5. Dabei kann die Prostata in den unterschiedlichsten Winkeln gekippt, durchgefächert und so komplett sichtbar gemacht werden5. Vor allem bei der Volumenbestimmung der Prostata gibt es klare Vorteile für die 3-dimensionale Darstellung5. Bei der Diagnostik des Prostatakarzinoms ist die Datenlage hingegen sehr heterogen5.
- CE-CD/PD-TRUS: Zur besseren Lokalisation von Tumoren und zur Verstärkung von CD- und PD-TRUS -Signalen können spezielle Ultraschallkontrastmittel eingesetzt werden5. Mehrere Autoren berichteten in kleinen Fallstudien über eine signifikant verbesserte Sensitivität bei der Detektion von Prostatakarzinomen bei gleichbleibender Spezifität5.
Generell sollten folgende 4 Malignitätskriterien sonografisch nachweisbar sein1:
1. verstärkte Durchblutung
2. unregelmäßige Begrenzung
3. nodulare oder Cluster-Auffälligkeit
4. Ausdehnung der Auffälligkeit an die Außenseite der peripheren Zone
- Biopsie: Die definitive Diagnosestellung ist nur mit Hilfe der Biopsie möglich12. Sie erfolgt in den meisten Fällen zur Abklärung eines erhöhten PSA Wertes11. Mit ihr kann sowohl gezielt Gewebe auffälliger Areale im Ultraschall (nach den oben definierten Malignitätskriterien) zusätzlich zur systematischen Gewebsentnahme gewonnen werden1. Die Stanzbiopsie soll unter transrektal-sonographischer Kontrolle erfolgen112, aber auch eine transperineale Durchführung ist möglich2. Neben der Durchführung einer Biopsie im suspekten Bereich, sollte auch das umgebe Gewebe biopsiert werden, um eine mögliche Tumorausdehnung zu entdecken2. Bei der Stanzbiopsie sollen in der Regel 10- bis 12 Gewebezylinder1112 entnommen werden, je fünf- bis sechs Zylinder aus dem rechten und dem linken Prostatalappen1. Sie sollten nach einem festen Schema aus den Regionen (Apex, Mitte und Basis) stammen1. Ggf. können zusätzliche Biopsien aus klinisch suspekten Arealen erfolgen1. Bei der Biopsie muss die Entnahme-Zone der Prostata (laterale periphere, mittlere periphere und transitionale Zone) angegeben werden111.
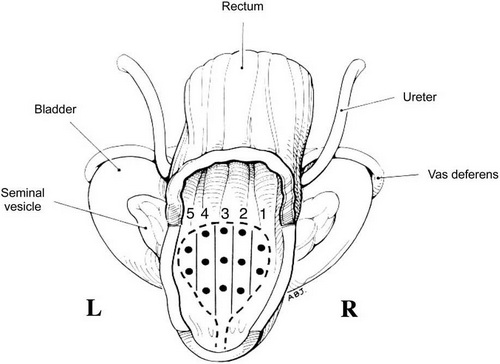
Abb. 628: Anatomisches Modell der Prostata mit Ansicht von dorsal durch die rektale Wand. Erkennbar sind die 5-Regionen, aus denen Biopsien genommen werden sollten. Jeder Punkt steht für eine Probeentnahme; insgesamt werden hier 13 Biopsien aus allen 5 anatomischen Regionen entnommen. L, links. R, rechts; Quelle: K. Eichler et al.; Diagnostic Value of Systematic Biopsy Methods in the Investigation of Prostate Cancer: A Systematic Review The Journal of Urology; Volume 175, Issue 5, May 2006, Pages 1605-1612
Die einzelnen Stanzzylinder sollen in separaten Proberöhrchen versendet werden111. So lassen sich die entnommenen Proben später genau zuordnen111. Ist aufgrund eines sehr kleinen Prostatavolumens die erforderliche Zahl an Proben nicht zu gewinnen, sind mindestens sechs Biopsien zu entnehmen1. Die falsch-negativen Raten bei der Stanzbiopsie reichen von 12% bis 28%. Diese Werte variieren in Abhängigkeit von der Art der Biopsie, dem Grad des Tastbefundes und der Anzahl der Biopsien2. Die positive Biopsierate bei Patienten mit erhöhtem PSA Wert und/oder suspekter DRU liegt derzeitig bei nur 20–25%12. Problematisch ist auch, dass eine negative Biopsie das Vorgandensein eines Prostatakarzinoms nicht ausschließen kann12.
Bei folgenden Befundkonstellationen soll eine erneute Biopsie innerhalb von 6 Monaten empfohlen werden1:- ausgedehnte High-Grade PIN (Nachweis in mindestens 4 Gewebeproben);
- ASAP
- suspekter PSA -Wert bzw. PSA -Verlauf
- wenn nur sehr wenig oder kein Drüsen- oder Stomagewebe gewonnen werden konnte
- Diese Empfehlung stützt sich auf die Beobachtung, dass Patienten mit ASAP oder High-Grade-PIN ein erhöhtes Risiko für ein invasives Prostatakarzinom in der Wiederholungsbiopsie haben1. Das in der Literatur angegebene Intervall zur Kontrollbiopsie liegt zwischen sechs und zwölf Monaten1.
Negative Biopsien bei klinisch suspekten Karzinomen sind nichts Ungewöhnliches und nicht gleichbedeutend mit einer falsch-negativen Biopsie, da nur in etwa 50% der Prostataknoten ein Tumor enthalten ist2. Ein Tumor-Seeding entlang der Einstichstelle sind bei dünnen Nadeln bis jetzt noch nicht beschrieben worden2. - MRT: Die MRT ist bislang das beste bildgebende Verfahren zum Tumornachweis in der Prostata6. Bei klinischem Verdacht auf ein Karzinom kann die MRT tumorverdächtige Herde in der Prostata lokalisieren und das Volumen der Prostata bestimmen. Die in der Literatur angegebenen Testgüteparameter für die MRT variieren je nach eingesetzter Technik stark mit einer Sensitivität von 76 – bis 87 % und einer Spezifität von 60- bis 98 [12]. Nicht nur für die Detektion des Primärtumors, sondern auch für die Beurteilung einer Kapselüberschreitung und Samenblaseninfiltration (T2 vs. T3a bzw. T3b) werden in der Literatur exzellente Daten zur Testgüte angegeben5. Sensitivitäten und Spezifitäten bezüglich der Kapselüberschreitung liegen im Bereich von 80–95 bzw. 82–935. Genauigkeiten werden zwischen 82 und 88% angegeben5.Vor allem die T2-gewichtete MRT der Prostata ist sehr gut geeignet, um die zonale Anatomie der Prostata als auch Binnenveränderungen zu beurteilen5. So stellt sich die Prostatakapsel als schmales hypointenses organbegrenzendes Band dar, während eine gesunde periphere Zone (P-Zone) homogen hyperintens erscheint und sich vom zentralen Drüsenanteil durch eine dunkle Bande, die Pseudokapsel, abgrenzt5. Zentrale Drüsenanteile (zentrale Zone, Transitionalzone) sind hingegen in ihrer Signalgebung z. T. sehr heterogen5. Während sich Prostatakarzinome in der T2-gewichteten Bildgebung typischerweise als hypointense Areale darstellen, die sich meist gut von der hyperintensen P-Zone abgrenzen lassen, sind Karzinome in zentralen Drüsenabschnitten wesentlich schwerer zu detektieren56. Als zuverlässige MRT -Zeichen für ein Tumorgeschehen gelten die Verlegung des rektoprostatischen Winkels, die Seitenungleichheit der neurovaskulären Bündel und die unmittelbar erkennbare Tumorausdehnung über die Prostatakapsel hinaus6. Aktuelle Publikationen zur DCE-MRT berichten nach intravenöser Applikation von gadoliniumbasierten Kontrastmitteln in der zeitlich hochaufgelösten Bildgebung über gute Detektionsmöglichkeiten auch in T1-gewichteten Sequenzen5. Eine erhöhte „micro vessel density“ der Karzinome korreliert sehr gut mit der Kontrastmittelaufnahmekinetik und kann zwischen gesundem und neoplastischem Gewebe differenzieren56. Beim Staging des Prostatakarzinoms zum Ausschluss von Lymphknotenmetastasen nimmt die MRT aufgrund ihrer diesbezüglich sehr eingeschränkten Sensitivität und Spezifität keinen Stellenwert ein und wird in den Leitlinien der EAU nicht empfohlen5.
- MRS: Während die Bilder bei der konventionelle Kernspintomographie hauptsächlich durch Wasser- und Fettanteile generiert und als Graustufenbilder dargestellt werden, können mit der MRS andere biochemische Substrate dargestellt und gemessen werden5. Dabei werden klassische Signale unterdrückt und gleichzeitig Signale von Metaboliten verstärkt, die charakteristisch für die Prostata sind, wie z. B. Zitrat, Kreatin und Cholin56. Die für die gesunde Prostata charakteristisch hohen Zitratkonzentrationen, sind im Prostatakarzinom kaum oder deutlich erniedrigt nachweisbar56. Außerdem führt der erhöhte Zellumsatz mit Aufbau von Tumorzellen und beschleunigtem Zelluntergang (Apoptose) zu einer Konzentrationserhöhung freier, cholinhaltiger Moleküle im Zytosol und Interstitium56. Sie sind wesentliche Bestandteile von Zellmembranen, die in tumorösen Arealen der Prostata in höherer Dichte vorkommen als in gesundem Prostatagewebe56. Die MRS der Prostata stellt die Kennlinien von Zitrat und Cholin im Spektrum dar und eignet sich daher prinzipiell für den Nachweis gesunden Prostatagewebes mit hohem Zitrat- und geringem Cholinanteil und tumorös entarteter Prostataareale mit verringertem Zitrat- und erhöhtem Cholinanteil56.
- ¹⁸F-FDG-PET: Da ein Großteil der Prostatakarzinome im Vergleich zu anderen, aggressiveren Tumorentitäten einen nur gering gesteigerten Glukosemetabolismus zeigt, was auf die langsamere Proliferationsrate der Tumoren zurückzuführen ist, und obwohl der ¹⁸F-FDG Uptake mit dem Gleason-Score, dem PSA Wert und der PSA Velocity zu korrelieren scheint, besitzt diese Untersuchung eine nur eingeschränkte Eignung in der Prostatakarzinomdiagnostik5. Neben der ¹⁸F-FDG gibt es aber noch weitere Tracer, die geeigneter zu sein scheinen5. So konnte gezeigt werden, dass in Prostatakarzinomen der ¹¹C-Cholin-Uptake erheblich höher ist als der ¹⁸F-FDG Uptake512. Aufgrund der geringen HWZ des ¹¹C-Cholins kommt vorzugsweise ¹⁸F-markiertem Cholin (HWZ ~6 h) zum Einsatz5. Ein weiterer PET Tracer, der in der Prostatakarzinomdiagnostik eingesetzt wird, ist ¹¹C-Azetat512. Ähnlich wie beim Cholin wird vermutet, dass der erhöhte Azetat-Uptake im Tumorgewebe einen erhöhten Zellmembranumsatz widerspiegelt5. Weitere potenziell nützliche Tracer sind ¹⁸F-Fluorodihydrotestosteron, das eine hohe Affinität zu Androgenrezeptoren aufweist, sowie das Aminosäureanalogon ¹¹C-Methionin5. Es sei jedoch anzumerken, dass insbesondere inflammatorische Prozesse der Prostata, aber auch die BPH einen malignen Befund vortäuschen können und somit eine Limitation der Untersuchung darstellen5. Da Cholin- bzw. Azetat-basierende PET Untersuchungen bisher nicht ausreichend validierte bildgebende Modalitäten bei Diagnose und Staging des Prostatakarzinoms sind, sollte aus diesem Grund die PET außerhalb von Studien nur in ausgewählten Einzelfällen zur Anwendung kommen5. Dies gilt insbesondere bei Patienten mit einem PSA Rezidiv5.
Allgemeines zur Therapie
Therapieplanung: Da es sich beim Prostatakarzinom um eine im Allgemeinen langsam progrediente Erkrankung mit langen Gesamtüberlebenszeiten auch ohne therapeutische Intervention handelt, sind die durch eine Therapie gewonnenen Lebensjahre gegen einen Verlust an Lebensqualität durch die Therapiefolgen abzuwägen1. Als Beispiel sei zu erwähnen, dass im reiferen Alter ein hohes Risiko einer Dekompensation der Blasenfunktion nach lokalen Therapiemaßnahmen besteht1. Folgende Faktoren sind bei der Entscheidung für eine nichtkurativ intendierte Therapiestrategie ausschlaggebend und sind vom behandelnden Arzt zu beachten1:
- Patientenpräferenz;
- eingeschränkte Lebenserwartung durch Alter oder Komorbiditäten;
- Erkrankung mit hohem Progressionsrisiko.
Ob ein lokal begrenztes Prostatakarzinom behandelt werden soll oder nicht, ist von verschiedenen Prognosefaktoren abhängig1. Hierzu zählen neben der klinischen Untersuchung der PSA Wert und der Gleason-Score1. Mit Hilfe dieser Faktoren lässt sich das Prostatakarzinom in drei Risikogruppen einteilen1.
- niedriges Risiko = PSA -Wert < 10 ng/ml und Gleason-Score < 6 und cTKategorie ≤ T2a;
- intermediäres (mittleres) Risiko = PSA -Wert > 10-20 ng/ml oder Gleason-Score 7 oder cT-Kategorie T2b;
- hohes Risiko = PSA -Wert > 20 ng/ml oder Gleason-Score > 8 oder klinisches Stadium > T2c.
Unerwünschte Wirkungen der Therapie: Gravierende unerwünschte Wirkungen und Folgen der lokalen Therapie des Prostatakarzinoms sind Sexualstörungen in Form von erektiler Dysfunktion, Dick- und Enddarmbeschwerden sowie Störungen der Kontinenz und Harnblasenfunktion1. Seit Einführung der nerverhaltenden Prostatektomie sind die Raten an erektiler Dysfunktion deutlich gesunken1. In vergleichenden Beobachtungsstudien ist die Häufigkeit von Sexualstörungen nach LDR -Brachytherapie niedriger als nach radikaler Prostatektomie oder perkutaner Strahlentherapie1. Eine intestinale Symptomatik (z. B. erhöhte Stuhlfrequenz, rektale Blutung) tritt häufiger nach perkutaner Bestrahlung oder Brachytherapie als nach radikaler Prostatektomie in Erscheinung1. Harninkontinenz oder Harnverhalt treten dagegen häufiger nach radikaler Prostatektomie auf als nach perkutaner Strahlentherapie oder LDR -Brachytherapie1.
Eine für radiotherapeutische Verfahren spezifische Nebenwirkung ist das Auftreten von Zweitmalignomen1.
Therapieoptionen
Active Surveillance: Definitionsgemäß hat Active Surveillance bei ansonsten gesunden und für eine radikale chirurgische Therapie geeignete Patienten das Ziel, unter genauer Überwachung einschließlich Kontrollbiopsie die rechtzeitige kurative Behandlung bis zu einem Zeitpunkt aufzuschieben, an dem sich möglicherweise die Tumorbiologie oder der Wunsch des Patienten ändern1. Als häufigste sekundäre Behandlung wird dabei bislang die RPE gewählt (48%)1. Voraussetzung für die Wahl einer Active-Surveillance-Strategie sollten folgende Parameter sein1:
- PSA -Wert ≤ 10 ng/ml
- Gleason-Score ≤ 6
- cT1c und cT2a
- Tumor in ≤ 2 Stanzen
- ≤ 50 % Tumor pro Stanze
Der Tumor sollte dabei in den ersten beiden Jahren durch PSA Bestimmung und DRU in dreimonatigem Abstand kontrolliert werden1. Bleibt der PSA Wert stabil, ist 6-monatlich zu untersuchen1. Biopsien sollen in den ersten 3 Jahren alle 12 bis 18 Monate vorgenommen werden, danach bei stabilem Befund alle 3 Jahre1. Eine Therapie des Tumors soll verlasst werden, wenn1:
- sich die PSA -Verdopplungszeit auf weniger als 3 Jahre verkürzt
- sich der Malignitätsgrad auf einen Gleason-Score über 6 verschlechtert
- Tumor in >2 von 10 bis 12 Stanzen nachgewiesen wird oder
- >50 % Tumor in einer Stanze nachgewiesen wird.
- der Patient es wünscht
Die Vorteile der Active Surveillance Strategie bestehen in einer Vermeidung von Übertherapie und ihrer potentiellen Nebenwirkungen1. Sowohl die AUA Leitlinie als auch die NICE -Leitlinie empfehlen ein Active Surveillance-Vorgehen auch bei Patienten mit intermediären Tumoren und Tumoren mit hohem Risiko als Therapieoption zu diskutieren1.
Watchful Waiting: Sie ist als palliative Strategie strikt von der Active-Surveillance abzugrenzen1. Patienten mit einer Watchful Waiting -Strategie werden erst bei einer symptomatischen Progression palliativ behandelt1. Diese Strategie kann Patienten mit einer mutmaßlichen Lebenserwartung < 10 Jahren, mit einem Tumor T1-T4, Gleason =/< 7 und beliebigen PSA -Werten angeboten werden1. Für den Zeitpunkt der verzögerten palliativen Intervention spielen nur die Tumorsymptome eine Rolle1.
RPE: Die RPE kommt als primäre Therapieoption sowohl für Patienten mit klinisch lokal begrenztem Prostatakarzinom als auch für Patienten mit lokal fortgeschrittenem Prostatakarzinom in Frage1. In die individuelle Entscheidung zur lokalen chirurgischen Therapie sollten Parameter der Tumorausdehnung einfließen1. Vor allem Patienten mit Tumoren bis cT3a, einem PSA < 20 oder einem Gleasonscore < 8 sind aufgrund der besseren Prognose geeignet für eine RPE. Sie sollte vor allem bei Prostatakarzinomen Anwendung finden, bei denen mit hoher Wahrscheinlichkeit eine R0-Resektion erreicht werden kann1.
In einer prospektiv randomisierten Studie konnte gezeigt werden, dass bei Patienten mit klinisch lokal begrenztem Tumor (T1b-T2 N0 M0), einem PSA -Wert unter 50 ng/ml und einer Lebenserwartung von mindestens 10 Jahren die RPE signifikant sowohl die Häufigkeit einer Progression als auch das Risiko von Fernmetastasen, die prostatakarzinomspezifische Mortalität und die Gesamtmortalität gegenüber dem „Watchful Waiting“ senkt1.
Beim lokal begrenzten Prostatakarzinom führt die vollständige Entfernung der Prostata mit tumorfreien Resektionsrändern zur Heilung, sofern zum Zeitpunkt der Operation keine (Mikro-) Metastasierung nachgewiesen werden konnte1. Findet sich histologisch Tumorgewebe im Absetzungsrand (R1), ist dies mit einer erhöhten Rate an Tumorrezidiven verbunden1.
Zu den Zielen der radikalen Prostatektomie gehört neben der kompletten Exstirpation der Prostata mit tumorfreiem Resektionsrand und dem Erhalt der Harnkontinenz auch der Erhalt der Erektionsfunktion1.Bezüglich des letztgenannten Punktes sei jedoch anzumerken, dass dies nicht bei jedem Patienten möglich ist1. Nach den EAU Guidelines gelten folgende „klare Kontraindikationen“ für ein nervenerhaltendes Vorgehen: hohes Risiko für extrakapsuläres Wachstum, d. h. cT3, cT2c, Gleason-Score >7 oder mehr als eine positive Biopsie mit Gleason-Score ≥ 7 auf der ipsilateralen Seite1.
Zur Durchführung einer radikalen Prostatektomie kommen folgende Operationsverfahren bzw. operativen Zugänge in Betracht1:
- retropubisch;
- perineal;
- laparoskopisch (intra- oder extraperitoneal);
- roboter-assistiert laparoskopisch (intra- oder extraperitoneal)
Potenzielle Vorteile des perinealen Zugangs gegenüber dem retropubischen Vorgehen sind eine geringere Invasivität und ein geringerer Blutverlust1. Mögliche Nachteile umfassen: a.) die Notwendigkeit eines separaten (laparoskopischen) Zugangs, falls eine pelvine Lymphknotendissektion erfolgen soll, b.) große Prostatae müssen gelegentlich intrakorporal geteilt werden, um sie entfernen zu können und c.) eine erhöhte Rate an Stuhlinkontinenz1 . Auch beim laparoskopischen (einschließlich Roboter-assistierten) Vorgehen sind der intraoperative Blutverlust und die Transfusionsrate gegenüber dem retropubischen Vorgehen geringer1. Weitere potenzielle Vorteile gegenüber der retropubischen Prostatektomie sind: a.) geringerer perioperativer Schmerzmittelbedarf, b.) kürzere Krankenhausverweildauer und c.) kürzere Katheterverweildauer1. Ein möglicher Nachteil ist eine längere Operationszeit1. Weiterhin liefern vergleichende Studien Hinweise darauf, dass Potenz- und Kontinenzergebnisse beim rein laparoskopischen Vorgehen möglicherweise schlechter sind, als bei der retropubischen bzw. perinealen Prostatektomie1.
Zu den allgemeinen Vorteilen der RPE gehört die genaue Bestimmung des Tumor- und Nodalstatus1. Dadurch kann eine adjuvante Therapie (hormonablative Therapie, Strahlentherapie) gezielt eingesetzt oder vermieden werden1. Demgegenüber wird bei high-risk-Patienten immer eine Strahlenbehandlung (auf Basis der klinischen Stadieneinteilung) in der Regel zusammen mit einer neo-/adjuvanten hormonablativen Therapie durchgeführt1. Ein weiterer Vorteil des operativen Vorgehens gegenüber der alleinigen Strahlentherapie ist die einfachere Nachbeobachtung des PSA1. Ein Nachteil der RPE gegenüber der Strahlentherapie ist das höhere Risiko für allgemeine und spezifische Operationskomplikationen, Impotenz und Inkontinenz1.
LND: Bei Patienten mit Prostatakarzinom und niedrigem Risiko (cT1c und PSA < 10 und Gleason ≤ 6) kann auf eine LND verzichtet werden1. Bei Patienten mit fortgeschrittenen Tumoren kann eine LND in Erwägung gezogen werden, ihr kurativer Nutzen ist jedoch nicht belegt1. Obgleich das Risiko für einen Lymphknotenbefall bei lokal fortgeschrittenem Prostatakarzinom höher ist als bei einem lokal begrenzten Tumor, existieren keine Studien, die eine gesicherte Wirksamkeit der LND in Bezug auf eine relevante klinische Verbesserung des Krankheitsverlaufs zeigen1. Die pelvine LND hat aber insofern eine wichtige Funktion, da sie die Grundlage für die Entscheidung über eine adjuvante Therapie bildet1. Eine Indikation zur LND stellt sich bei PSA ≥10 und/oder Gleason-Score >79. Grundsätzlich sollte bei Patienten der klinischen Kategorie T3, die ein hohes Risiko für einen Lymphknotenbefall haben, eine LND mit histologischer Sicherung des Lymphknotenstatus erfolgen1. Nur, wenn dies nicht möglich ist, sollte das Risiko anhand der Bildgebung abgeschätzt werden1. Wird eine LND durchgeführt, so sollten mindestens 10 Lymphknoten entnommen werden1. Bei gestellter Indikation sollte diese am besten extendiert erfolgen, da hierbei der Nachweis von Lymphknotenmetastasen 2- bis 3-fach höher ist als im Vergleich zur Standard- LND. Die extendierte LND sollte dabei die folgenden drei Lymphknotenstationen umfassen: Vena iliaca externa, Arteria iliaca interna und Fossa obturatoria1. Zudem sollten die Lymphknoten medial der A. Iliaca interna (auch als praesakrale Lymphknoten beschrieben) mit entfernt werden1. Insgesamt muss bei der extendierten LND eine erhöhte Morbidität berücksichtigt werden1.
Bei Durchführung einer LND muss zwischen dem kurativ diagnostischen Vorteil und der Morbidität abgewogen werden1. Einerseits ist der Nachweis von Lymphknotenmetastasen mit einem deutlich schlechteren Verlauf der Tumorerkrankung vergesellschaftet und bedarf einer sofortigen oder verzögerten hormonablativen Therapie, andererseits ist sie mit Risiken behaftet (Lymphozelen, Thrombosen, Lymphödeme), so dass ihre Indikation bei negativem Lymphknotenbefund als fraglich erscheint1.
Therapie des lymphknotenpositiven Prostatakarzinoms: Lokale Behandlungsoptionen für Patienten mit histologisch gesicherten Lymphknotenmetastasen umfassen die operative Therapie und die Strahlentherapie1. Als systemische Behandlung steht weiterhin die sofortige oder die verzögerte hormonablative Therapie zur Verfügung1. Kommt eine Strahlentherapie bei Patienten mit histologisch gesicherten Lymphknotenmetastasen zum Einsatz, so soll diese am besten in Kombination mit einer hormonablativen Therapie von mindestens 2, besser 3 Jahren Dauer durchgeführt werden1. Nach radikaler Prostatektomie bei Patienten mit histologisch gesicherten Lymphknotenmetastasen kann eine adjuvante hormonablative Therapie angeboten werden1.
Primäre perkutane Strahlentherapie: Die perkutane Strahlentherapie auf Basis der dreidimensionalen (3D-konformalen) Bestrahlungsplanung in Kombination mit einer hormonablativen Therapie ist eine primäre Therapieoption sowohl für Patienten mit lokal begrenztem als auch lokal fortgeschrittenem Prostatakarzinom1. Hierbei sollte mit einer Dosis von ca. 74 Gy bis < 80 Gy in Standardfraktionierung (1,8 bis 2,0 Gy, siehe Hintergrundtext) [nach ICRU 50] bestrahlt werden1. Durch die 3D-konformale Strahlentherapie ist eine Dosiserhöhung mit dem Ziel einer besseren Tumorkontrolle möglich1. Sie ist jedoch mit einem erhöhten Risiko der strahlentherapiebedingten Toxizität verbunden1.
Bei Patienten mit Tumoren des niedrigen Risikoprofils steht dem Risiko von Nebenwirkungen bei hormonablativer Therapie mitunter ein sehr geringer Nutzen hinsichtlich des Gesamtüberlebens gegenüber1. Deshalb sollte – sofern diese Option gewählt wird – lediglich eine Kurzzeittherapie erfolgen1. Sie kann jedoch bei lokal begrenztem Prostatakarzinom und mittlerem Risikoprofil als neoadjuvante und/oder adjuvante Therapie zur Anwendung kommen1. In einer randomisierten kontrollierten Studie mit Patienten, die ein lokal fortgeschrittenes Prostatakarzinom hatten, konnte gezeigt werden, dass eine perkutane Strahlentherapie in Kombination mit einer langfristigen hormonablativen Therapie gegenüber einer alleinigen langfristigen hormonablativen Therapie (Flutamid nach 3-monatiger maximaler Androgenblockade) die prostatakarzinomspezifische Mortalität und die Gesamtmortalität senkt1. Diese Ergebnisse spiegeln sich in der Verbesserung des biochemisch rezidivfreien Überlebens, des krankheitsspezifischen Überlebens und des Gesamtüberlebens wieder1. Die Kombination ist aber auch einer alleinigen perkutanen Strahlentherapie überlegen1. Aus diesem Grund sollten Patienten mit lokal fortgeschrittenem Prostatakarzinom, die sich für eine Strahlentherapie entscheiden, zusätzlich zur perkutanen Strahlentherapie eine hormonablative Therapie erhalten1. Die Gesamtdauer der hormonablativen Therapie soll mindestens 2, besser 3 Jahre betragen1. Hiervon können bis zu 6 Monate neoadjuvant erfolgen1. Die genannte Dauer der hormonablativen Therapie ist allerdings nicht bindend, sie sollte in Abhängigkeit von Komorbidität, Alter, Lebenserwartung und Tumorausdehnung individuell getroffen werden1.
Der Stellenwert einer Bestrahlung der pelvinen Lymphabflusswege zusätzlich zur Prostatabestrahlung bei Patienten mit lokal begrenztem als auch lokal fortgeschrittenem Prostatakarzinom ist nicht geklärt1.
LDR -Brachytherapie: Die interstitielle LDR -Monotherapie ist eine primäre kurative Therapieoption zur Behandlung des lokal begrenzten Prostatakarzinoms bei Patienten mit niedrigem Risikoprofil17. Dafür sprechen die hohen prozentualen Raten PSA-rezidivfreier Verläufe (bis >90%) bei Low-risk-Tumoren und D90 ≥130–140 Gy7. Sie ist somit als ein alternatives therapeutisches Verfahren sowohl zur radikalen Prostatektomie als auch zur perkutanen Strahlentherapie anzusehen1. Bei Patienten mit einem Prostatakarzinom hohen Risikos ist eine LDR -Monotherapie nicht indiziert17. Als ideal geeignet für die LDR -Monotherapie sind Patienten mit einem PSA -Wert unter 10 ng/ml, einem Gleason-Score unter 7 sowie einem cT1c bis cT2 Tumor1.
Bei der LDR Brachytherapie erfolgt die Applikation von Implantaten mit Jod-125 bzw. Palladium-103 transperineal17. Die gering invasive Implantation erfolgt in Spinal- oder Allgemeinanästhesie17. Weitere Vorteile umfassen weniger Nebenwirkungen bezüglich einer therapiebedingten Belastungsinkontinenz und erektilen Dysfunktion1. Die Verschreibungsdosis für Jod-Seeds beträgt 145 Gy7, bei Verwendung von Palladium Seeds 125 Gy1. Bei der kombinierten interstitiellen und perkutanen Therapie, die an manchen Zentren bei Patienten mit Tumoren des mittleren Risikoprofils (gemessen am Ausgangs PSA -Wert, dem Gleason-Score und der klinischen Tumorkategorie) angewendet wird, betragen die Verschreibungsdosen für die Jod-Seeds 100-120 Gy und die Dosis der perkutanen Bestrahlung 45-50 Gy17. Für Palladium-103 betragen die entsprechenden Dosen 80-90 Gy (interstitiell) und 45-50 Gy (perkutan)1.
Üblich ist die intraoperative Planung der Positionierung der Seeds, d.h. ihre Implantation kann durch eine begleitende, computergestützte Dosisberechnung kontrolliert werden17. Dadurch kann die Dosisverteilung während des Eingriffs durch entsprechende Positionierung der noch einzusetzenden Seeds ggf. korrigiert werden (dynamische Planung)17. Sie werden entweder in Ketten (eingewoben in einen versteiften Vicrylfaden oder verbunden durch biodegradierbare Platzhalter) oder als Einzelseeds mit dem Mick-Applikator implantiert1. Einen besonderen Stellenwert hat die sogenannte ‚Nachplanung’17. Vier bis sechs Wochen nach Implantation sollte eine post Implantations-CT erfolgen17. Als exzellente Implantation gilt das Erreichen von 100 % der Verschreibungsdosis auf mindestens 90 % des Prostatavolumens (D90 (Dosis, die min-destens 90% des Prostatavolumens ab¬deckt) )17.
HDR -Brachytherapie: Die HDR -Brachytherapie in Kombination mit der perkutanen Strahlentherapie, ist eine primäre Therapieoption sowohl beim lokal begrenzten Prostatakarzinom als auch bei Patienten mit Tumoren des mittleren und hohen Risikoprofils1. Sie findet in der Regel als Boost-Methode Anwendung7 und wird gerne bei Patienten mit lokal fortgeschrittenem Prostatakarzinom der klinischen Kategorie cT3 mit einer perkutanen Strahlentherapie kombiniert1. In den folgenden Jahren konnten mehrere Studien zeigen, dass sich mit einer Dosiseskalation so¬wohl die Lokalrezidivrate als auch die Ra¬te der Fernmetastasierung reduzieren ließ7. Aber auch im Sinne einer Monotherapie als weitere kurative Option bei Low-risk-Tumoren kommt die HDR -Brachytherapie zum Einsatz7. Erste Ergeb¬nisse der Monotherapie sind ermutigend und zeigen im Vergleich zur Seed-Brachytherapie eine geringere Toxizität7. Bei der HDR -Brachytherapie werden temporär lokale Strahlenträger im Sinne einer Afterloadingtechnik in Spinalanästhesie in die Prostata eingebracht17. Insge¬samt werden 50 Gy appliziert, mit einer perkutanen Frak¬tionierung in 2 Gy pro Sitzung7. Bei Tumoren der klinischen Kategorie cT4 ist die HDR -Brachytherapie nicht indiziert1. Der Stellenwert einer zusätzlichen hormonablativen Therapie ist nicht geklärt1.
Adjuvante perkutane Strahlentherapie: Als adjuvante perkutane Strahlentherapie wird die postoperative Strahlentherapie (mit 60-64 Gy) nach radikaler Prostatektomie und Erreichen des definierten PSA -Nullbereichs bezeichnet1. Patienten mit pT3pN0-Tumoren und positivem Schnittrand sollte eine adjuvante Radiotherapie als Option angeboten werden1. Gleiches gilt für Patienten mit pT3-Tumoren und negativem Schnittrand, bei denen jedoch eine Samenblaseninfiltration vorliegt1. Hier ist allerdings der zu erwartete Effekt geringer ist als bei Patienten mit positivem Schnittrand1. Die adjuvante Strahlentherapie sollte sich in der Regel bis vier Monate nach RPE anschließen1. Sie wird jedoch nicht als Standardtherapie angesehen1. Eine therapeutische Alternative stellt die perkutane Bestrahlung bei PSA-Anstieg (Salvagestrahlentherapie dar)1.
Neoadjuvante und adjuvante hormonablative Therapie: Vor und nach RPE soll bei klinisch und pathologisch lokal begrenztem Stadium als auch bei Patienten mit lokal fortgeschrittenen Tumoren und niedrigem Risikoprofil keine neoadjuvante bzw. adjuvante hormonablative Therapie erfolgen1. Gleiches gilt nach RPE ohne Lymphknotenmetastasen (PSA im Nullbereich)1.
Hingegen sollten Patienten mit lokal begrenztem Prostatakarzinom des hohen Risikoprofils zusätzlich zur perkutanen Strahlentherapie eine (neo-)und/oder adjuvante hormonablative Therapie erhalten1. Für diese Patienten konnte eine Verbesserung des progressionsfreien Überlebens sowohl bei einer 6-monatigen (neo-) und/oder adjuvanten hormonablativen Therapie als auch bei einer 2-3 Jahre dauernden hormonablativen Therapie in Kombination mit einer perkutanen Strahlentherapie gezeigt werden1.
Im nichtmetastasierten Stadium sprechen initial nahezu alle Adenokarzinome der Prostata auf eine hormonablative Therapie an1. Auf lange Sicht kann sich, insbesondere bei schlecht differenzierten Tumoren, eine Hormonresistenz einstellen1. Im Falle einer nur Monate dauernden neoadjuvanten Gabe spielt dies jedoch keine Rolle1. Als adjuvant wird eine Hormonbehandlung bezeichnet, wenn postoperativ ein PSA -Wert im definierten Nullbereich gegeben ist, keine sonstigen prostatakarzinomspezifischen Krankheitszeichen bestehen und die Therapie zeitnah nach der Operation begonnen wird1.
Die Therapie erfolgt auf der Basis pathomorphologischer Charakteristika des Tumors1. Insbesondere bei einem Gleason-Score zwischen 8 und 10 besteht eine statistisch signifikante Verbesserung des krankheitsfreien Überlebens1. Eine generelle adjuvante hormonablative Therapie nach RPE bietet keine Überlebensvorteile bei Patienten mit lokal begrenztem Tumor1. Patienten, die eine hormonablative Therapie erhalten, können entweder mit einer Therapie einhergehend mit dem Effekt einer Kastration (z. B. bilaterale Orchiektomie, LHRH-Analogon, GnRH-Blocker) oder mit einem geeigneten Antiandrogen behandelt werden1.
Patienten mit einem symptomatischen metastasierten Prostatakarzinom ist eine Androgendeprivation zu empfehlen1. Bei asymptomatischen Patienten mit metastasiertem Prostatakarzinom kann die Empfehlung fakultativ erfolgen1. Die Therapie kann entweder medikamentös oder operativ durchgeführt werden1. Patienten mit metastasiertem Prostatakarzinom kann alternativ zur Androgendeprivation eine Therapie mit einem nichtsteroidalen Antiandrogen angeboten werden1. Die kombinierte, maximale Androgenblockade kann als Primärtherapie zum Einsatz kommen1.
Bei hormonablativer Therapie sollten in drei- bis sechsmonatigem Abstand Kontrolluntersuchungen (Anamnese, körperliche Untersuchung und Labor mit Bestimmung des PSA -Werts und ggf. Serumtestosteron, Hämoglobin, und Alkalische Phosphatase) erfolgen, um ein Ansprechen der Hormondeprivation beurteilen zu können1.
Eine antiandrogene Therapie sollte nur eingesetzt werden bei1:
- einer PSA -Verdopplungszeit < 3 Monate
- symptomatischer lokaler Progression
- nachgewiesener Fernmetastasierung.
Therapie des androgenunabhängigen oder kastrationsresistenten Prostatakarzinoms: Die Behandlung des kastrationsresistenten Prostatakarzinoms ist eine palliative Therapie1. Ziele der Therapie sind die Verlängerung der Überlebenszeit, die Kontrolle von Symptomen, sowie die Verbesserung oder der Erhalt von Lebensqualität1. Patienten mit asymptomatischem Progress unter medikamentöser Kastration kann sowohl ein abwartendes Vorgehen unter Beibehaltung der bestehenden Androgendeprivation als auch eine sekundäre Hormonmanipulation oder aber unter Aufklärung über Nutzen und Nebenwirkungen eine Chemotherapie angeboten werden. Letztere sollte vor allem erfolgen bei1:
- raschem PSA -Anstieg
- Progression in der Bildgebung
- PSA -Anstieg und Therapiewunsch
Eine Verbesserung des Überlebensvorteils bei frühzeitigem Beginn der Chemotherapie im asymptomatischen Stadium gegenüber einem Therapiebeginn bei Symptomen ist nicht erwiesen1.
Patienten mit symptomatischer progredienter Erkrankung unter medikamentöser Kastration können je nach Manifestation der Erkrankung folgende therapeutische Konzepte angeboten werden1:
- Chemotherapie
- hormonablative Therapie
- Gabe von Steroiden (Dexamethason, Prednisolon, Prednison)
- Gabe von Bisphosphonaten/Anti-RANKL-Antikörper
- lokale perkutane Strahlentherapie
- Radionuklidtherapie
- symptombezogene Supportivtherapie
Patienten mit symptomatischer progredienter Erkrankung unter medikamentöser Kastration und gutem Allgemeinzustand sollten als Erstlinientherapie Docetaxel 75 mg/m2 Körperoberfläche alle drei Wochen in Kombination mit Prednisolon 5 mg zweimal täglich erhalten1.
Patienten mit progredienter Erkrankung nach/unter Chemotherapie und ECOG Status 0-1 sollen über die Möglichkeit einer Zweitlinientherapie mit Cabazitaxel, jene mit einem ECOG Status von 0-2 sollen über die Möglichkeit einer Zweitlinientherapie mit Abirateron informiert werden1. Weitere zytostatische Medikamente wie Docetaxel in wöchentlicher oder dreiwöchentlicher Dosierung, Mitoxantron oder Estramustin können Symptome lindern1. Ein positiver
Einfluss auf die Überlebenszeit ist jedoch nicht gesichert1. Bei Ablehnung einer zytostatischen Therapie kann bei symptomatischer progredienter Erkrankung die Gabe von Steroiden (Prednisolon/Prednison oder Dexamethason) angeboten werden1.
Therapie des PSA Rezidivs: Per definitionem handelt es sich bei einem persistierenden PSA -Wert nach RPE und erster postoperativer PSA -Kontrolle um einen Wert oberhalb des definierten Nullbereichs1. Ursächlich für einen persistierenden PSA -Wert kann einerseits die Belassung benigner Prostatazellen (z. B. im Bereich des Apex) im Rahmen der primären RPE sein, andererseits aber auch durch Tumorpersistenz bedingt sein1. Eine präzise Unterscheidung ist mit den bisher zur Verfügung stehenden diagnostischen Methoden nicht möglich1.
Folgende Faktoren sprechen für das Vorliegen eines Lokalrezidivs sind lt. Literatur positiv mit einem Therapieansprechen auf lokale Interventionen assoziiert1:
- initial „Low-Risk“-Tumor: klinische T1c oder T2a –Kategorie, Gleason-Score < 6, PSA -Wert < 10 ng/ml
- Intervall bis zum PSA -Rezidiv > 3 J
- PSA -Verdopplungszeit nach Primärtherapie > 12 Mo
- PSA -Anstieg < 2,0 ng/ml/J
- Anzahl pos. Biopsien < 50 %
- Art der vorangegangenen Strahlentherapie (vorangegangene Seeds-Implantation)
Bei Patienten mit PSA -Rezidiv und günstigen prognostischen Kriterien ist das abwartende Verhalten eine Möglichkeit1. Die perkutane SRT sollte als Therapieoption nach RPE bei PSA -Anstieg aus dem Nullbereich in der Kategorie pN0/Nx angeboten werden16. Als Dosis für die perkutane SRT werden in der Literatur 64-70 Gy genannt; empfohlen wird eine Dosis von mindestens 66 Gy1. Sie soll möglichst frühzeitig beginnen (PSA vor SRT < 0,5 ng/ml). folgender Faktoren gehen lt. Literatur mit einem Therapieansprechen der PSA -Progression bei SRT einher1:
- PSA -Wert vor SRT < 1 ng/ml
- PSA -Anstiegsgeschwindigkeit vor SRT < 2 ng/ml/J
- Intervall bis zum PSA -Rezidiv > 2-3 J
- PSA -Verdopplungszeit nach Primärtherapie > 12 Mo
- Gleason-Score < 8
- keine Samenblasen- oder Lymphknotenbeteiligung
- R1-Resektion
Eine diagnosesichernde Biopsie wird dabei nicht vorausgesetzt1.
Die SPT ist eine Therapieoption beim PSA -Rezidiv nach primärer perkutaner Strahlentherapie oder Brachytherapie, wenn die PSA -Progression mit hoher Wahrscheinlichkeit nicht durch eine Metastasierung bedingt ist16. Sie sollte möglichst frühzeitig erfolgen und ihr sollte eine bioptische Sicherung voraus gehen1. Ein Nachteil der Therapie beinhaltet schlechtere funktionelle Ergebnisse in Bezug auf Potenz und Kontinenz als bei primärer Operation19. Für die SPT werden Inkontinenzraten von im Mittel 41 % angegeben (KI:17-67 ), rektale Verletzungen zwischen 0-10 % (im Mittel 4,7 %) und Blasenhalsstrikturen zwischen 0 und 41 % (im Mittel 24 %)19. Ein Vorteil ist jedoch die Verringerung der rektalen Komplikationsraten über die Zeit1. Auch benötigen ca. 50 der so operierten Patienten innerhalb von 5 Jahren keine weitere Therapie9.
Die SRT und die SPT sind Therapieoptionen mit kurativer Intention1. Als invasive Maßnahmen sind sie jedoch mit unerwünschten Nebenwirkungen verbunden. Die Entscheidung zu einer Therapie soll demzufolge bestimmt werden durch1:
1) das Vorliegen günstiger Faktoren für eine „Wait-and-See-Strategie“;
2) die Lebenserwartung und die Begleiterkrankungen mit daraus resultierenden Behandlungsrisiken;
3) den Patientenwunsch in der Abwägung von Nutzen und unerwünschten Nebenwirkungen.
Die von Pound publizierte Serie konnte an einem Patientenkollektiv mit PSA -Rezidiv, die nicht behandelt wurden, zeigen, dass bei folgenden Patienten signifikant weniger Fernmetastasen auftraten wenn1:
1) PSA -Verdopplungszeit nach RPE > 10 Monate
2) Auftreten des PSA -Rezidivs mehr als zwei Jahre nach RPE
3) primärer Gleason-Score < 8
Als mögliche Kandidaten für ein abwartendes Verhalten kommen so gerade ältere Patienten mit primär günstigem Risikoprofil und den oben genannten drei Parametern in Frage1.
Der natürliche Verlauf bei PSA -Rezidiv nach RPE und bei PSA -Progression nach Strahlentherapie kann ohne jede Therapieintervention sehr langsam verlaufen und in vielen Fällen werden Patienten mit PSA -Rezidiv bzw. PSA -Progression keine klinisch relevanten Symptome entwickeln1. Ein Drittel der Männer mit einem postoperativen PSA -Anstieg entwickeln Metastasen innerhalb von 8 Jahren ab dem Zeitpunkt der PSA -Wert Erhöhung2.
Die hormonablative Therapie ist beim PSA -Rezidiv oder bei PSA -Progression keine Standardtherapie1.
Therapie von Knochenmetastasen: Bei über 80 % der Patienten mit metastasiertem Prostatakarzinom sind Knochenmetastasen nachweisbar1. Typische Prädilektionsstellen sind die Wirbelsäule, das Becken und der Brustkorb1. Hierbei treten überwiegend osteoblastische Metastasen auf1. Die mediane Überlebenszeit bei Knochenmetastasen beträgt ca. drei Jahre1. Während dieser Zeit leiden die Patienten vorwiegend unter Schmerzen, Hyperkalzämie, pathologischen Frakturen und Rückenmarkskompression1. Zur palliativen Therapie kommen neben der analgetischen Behandlung folgende Therapieformen in Frage1:
- antihormonelle Therapie
- Chemotherapie
- lokale Bestrahlung (ggf. in Kombination mit chirurgischer Intervention bei spinaler Kompression)
- Gabe von Bisphosphonat und von Denosumab sowie
- die Applikation von Radionukliden zur Verfügung
Die lokale perkutane Bestrahlung soll bei Knochenmetastasen in folgenden Situationen zum Einsatz kommen1:
- drohendem Querschnitt
- erhöhtem Frakturrisiko
Bei Persistenz lokalisierter Knochenschmerzen unter systemischer Therapie soll eine perkutane Bestrahlung angeboten werden1. Die vorliegenden randomisierten kontrollierten Studien zeigen eine partielle oder komplette Schmerzlinderung nach ca. drei- bis acht Tagen bei mehr als 80 % der Patienten1. Bei mindestens 50 % der Patienten hält diese Schmerzlinderung sechs Monate oder länger an1. Die Dosis sollte mind. 6 Gy (in der Regel 8 Gy) betragen1. Dabei spielt es in Bezug auf die Schmerzkontrolle keine Rolle, ob diese fraktioniert oder als Einmal-Bestrahlung gegeben wird1. Akute UAW umfassen Übelkeit und Erbrechen in ca. einem Viertel der Fälle1. Die Häufigkeit des Auftretens von Kompressionen des Rückenmarks oder pathologischen Frakturen im Bereich des Zielvolumens sind im weiteren Verlauf niedrig1. Die Inzidenz liegt in randomisierten kontrollierten Studien bei 1-2 % für Spinalkanalstenosen und bei 1-4 % für pathologische Frakturen1.
Zur Prävention von Komplikationen bei Knochenmetastasen im hormonrefraktären Stadium soll als Bisphosphonat Zoledronsäure angeboten werden1. Die Therapie mit Denosumab (humaner monoklonaler Antikörper gegen RANKL ) ist der Therapie mit Zoledronsäure in Bezug auf die Zeit bis zum Auftreten des ersten skelettbezogenen Ereignisses unter Therapie mindestens gleichwertig1. Durch die längerfristige Anwendung von Bisphosphonaten, aber auch von Denosumab können Kieferosteonekrosen verursacht werden1. Aufgrund dieser Beobachtungen ist eine zahnärztliche Untersuchung mit entsprechender zahnärztlicher Sanierung vor Bisphoshonat – oder Denosumabgabe obligat1.
Radionuklide können bei multiplen Knochenmetastasen im hormonrefraktären Stadium mit unzureichender Schmerzkontrolle zum Einsatz kommen1. Zugelassene Radionuklide umfassen die genannten Substanzen Sr-89, Sm-153 und Re-1861. Bei der Applikation von Sr-89 (in einer Dosierung von 150-200 MBq) setzt die Schmerzentlastung mit zwei- bis drei Wochen nach Therapiebeginn etwas später ein als bei der Applikation von Sm-153 (in einer Dosierung von 1,0 mCi/kg) mit ein- bis zwei Wochen1. Bei der Indikationsstellung sind die zu erwartenden Nebenwirkungen zu beachten1. Übelkeit und/oder Erbrechen tritt nur bei wenigen Patienten (bis zu 10 %) auf1. Die Behandlung führt jedoch regelhaft zu einer milden bis moderaten Myleosuppression1. Die Patienten sind darüber hinaus über eine möglicherweise auftretende vorübergehende Zunahme der Beschwerden (Flare-Phenomen) vor definitiver Schmerzlinderung aufzuklären1.
Bei hormonnaiven Patienten mit Symptomen einer spinalen Kompression ohne pathologische Fraktur besteht auch die Möglichkeit einer (notfallmäßigen) Hormonentzugstherapie1.
Eine operative Stabilisierung ist in der Regel bei drohender Frakturgefährdung oder nach pathologischer Fraktur, je nach Lokalisation, in Betracht zu ziehen1. Eine postoperative lokale Strahlentherapie (10 × 3 Gy) verringert signifikant die Reoperationsrate aufgrund von Prothesenlockerungen1.
Therapie der tumorbedingten Harnstauung: Beim Prostatakarzinom tritt eine Harnstauung bei 10- bis 16 % der Patienten auf1. Die Ureterobstruktion resultiert beim fortgeschrittenen Tumor entweder aus der direkten Kompression bzw. Infiltration der ureterovesikalen Verbindung oder indirekt aus der Anhebung des Trigonums der Harnblase, aus der Kompression durch Lymphknotenmetastasen oder der intraluminalen Metastasierung1. Da eine akute symptomatische Harnstauung zu Fieber, Sepsis, Niereninsuffizienz bis hin zum Nierenversagen führen kann, und nach Oefelein et al. die Prognose solcher Patienten schlechter ist, als jene ohne Harntransportstörung (mittleres Überleben 42 vs. 59 Monate), ergibt sich daraus die Empfehlung zur Harnableitung1. Beim fortgeschrittenen hormonnaiven Tumor gilt die Hydronephrose neben der Zahl der Knochenmetastasen (>5), den behandlungspflichtigen Schmerzen und der auf das Doppelte erhöhten alkalischen Phosphatase als einer von vier voneinander unabhängigen prognostischen Faktoren1. Es können sowohl Patienten mit einem hormonnaiven als auch solche mit einem kastrationsresistenten Tumor betroffen sein1. Patienten, die wegen eines hormonnaiven Protatakarzinoms eine Harnstauungsniere haben, sollten primär eine hormonablative Therapie erhalten1. Eine, durch ein nichthormonell vorbehandeltes Prostatkarzinom entstandene Obstruktion kann demnach im subakuten Falle durch eine Androgendeprivation behandelt werden1.
Patienten mit symptomatischer Harnstauung sollen durch instrumentelle Harnableitung therapiert werden1. Die Ableitung sollte wegen der hohen Versagerquote einer retrograden Sondierung, der häufigen vom unteren Harntrakt ausgehenden Irritationen sowie wegen der nicht optimalen Drainage und der Migrationsgefahr des Stents vorzugsweise perkutan erfolgen1. Die perkutane Nephrostomie ist dabei die sicherste und effektivste Methode der Harnableitung für die Mehrzahl der Patienten mit bestehender Harnleiterobstruktion beim Prostatakarzinom1.
Supportiv Therapie: Die häufigsten unerwünschten Folgen nach RPE umfassen erektile Dysfunktion, Inkontinenz und Urethrastriktur1.
| Maßnahmen | |
|---|---|
| Erektile Dysfunktion | Als supportive Maßnahme zur Behebung der erektilen Dysfunktion sollte zunächst ein PDE 5-Inhibitor eingesetzt werden1. Bei Ineffektivität der Therapie sollten intrakavernöse Injektionen oder intraurethrale Prostaglandine (Aldoprostadil) oder Vakuumerektionshilfesysteme unter Berücksichtigung der Patientenpräferenz in Erwägung gezogen werden1. |
| Harninkontinenz | Die postoperative Harninkontinenz nach RPE soll multimodal therapiert werden1. Im Mittelpunkt des Kontinenztrainings bei Belastungsinkontinenz steht die Physiotherapie1. Liegt eine höhergradige Inkontinenz vor, so sollten zusätzlich blasenfunktionsstabilisierende Medikation und/oder eine Elektrostimulationstherapie zum Einsatz kommen1. Bei weiterhin bestehenden Beschwerden kommt das endoskopische Video-Biofeedback-Sphinktertraining zum Einsatz1. |
| Urethrastrikturen | Das Auftreten von Urethrastrikturen wird in der Literatur mit 0,5- bis 9 % angegeben, im deutschen Raum wird die Häufigkeit derzeit mit ca. 3 % angegeben1. Therapieoptionen sind entweder konservativer Natur durch Bougierung der Urethra oder operativ; hier stehen verschiedene Techniken zur Verfügung1. |
Lymphozelen nach LND werden in der neueren Literatur mit einer Rate von ca. 10- bis 18 % angegeben; dabei korreliert das Auftreten hochsignifikant positiv mit dem Durchführen einer erweiterten LND und der Anzahl der entfernten Lymphknoten1. Da Lymphozelen hämodynamisch relevant werden können, stellen sie einen Risikofaktor für thrombembolische Ereignisse dar1. Sie sollen deshalb postoperativ diagnostiziert und ggf. per Dopplerflowmessung auf ihre hämodynamische Bedeutung hin untersucht werden1. Bei hämodynamischer Relevanz oder Auftreten anderer Beschwerden soll die Lymphozele entlastet werden1. Hierzu steht als erstes Verfahren die sonographisch gestützte Drainageeinlage zur Verfügung1. Infizierte Lymphozelen sind lokal antibiotisch zu behandeln1.
Die strahlenbedingte akute Proktitis kann mit Sucralfat, Butyrat oder Hydrocortison topisch behandelt werden1. Die Behandlung der strahlenbedingten Diarrhoe soll symptomatisch erfolgen (Gabe von Loperamid oder Octreotid, wenn indiziert auch Elektrolyt und Flüssigkeitssubstitution)1.
Weitere supportive Maßnahmen umfassen die Therapie der Nebenwirkungen der Hormon-, Strahlen-, und Chemotherapie1.
Palliativtherapie: Das Ziel der Palliativtherapie ist die Verbesserung der Lebensqualität durch die effektive Behandlung von belastenden Symptomen1. Hierunter fallen bei Patienten mit fortgeschrittenem Prostatakarzinom Schmerzen, Fatigue, Gewichtsverlust, Angst, Depression und organbezogene Symptome (z. B. Lähmungserscheinungen und Harnverhalt)1.
Nachsorge und Tumorrezidiv
Asymptomatische Patienten nach lokaler kurativ intendierter Therapie sollen innerhalb von 12 Wochen nach Ende der Therapie die erste Nachsorgeuntersuchung wahrnehmen1. Bei asymptomatischen Patienten sollten die Untersuchungen dann innerhalb der ersten 2 Jahre vierteljährlich, im 3. und 4. Jahr halbjährlich und vom 5. Jahr an in jährlichen Intervallen wiederholt werden1. Dabei soll bei asymptomatischen Patienten nach kurativ intendierter Therapie die Bestimmung des Serum-PSA -Werts zur Nachsorge eingesetzt werden16. Nach lokaler Therapie sollte ein Basiswert innerhalb von sechs und zwölf Wochen ermittelt werden, um weitere therapeutische Konsequenzen z. B. aus einem fehlenden PSA -Abfall nach radikaler Prostatektomie zu ziehen1. Die Diagnose eines Rezidivs erfolgt primär durch den Nachweis eines PSA -Anstiegs, d. h. biochemisch1. Die Definition des relevanten PSA -Rezidives umfasst ein in mindestens zwei Messungen bestätigter ansteigender PSA -Wert von > 0,2 ng/ml (nach RPE oder alleiniger Radiotherapie), gemessen im Abstand von mindestens zwei Wochen16. Allerdings können bei langsam progredienten Tumoren auch zwei ansteigende Werte < 0,2 ng/ml ein biochemisches Rezidiv bedeuten1.
Ein PSA -Anstieg nach RPE oder kurativ intendierter Radiotherapie kann entweder durch ein Lokalrezidiv oder durch Metastasen bedingt sein1. Die Lokalisation des Rezidivs ist nur dann von entscheidender Bedeutung, wenn eine entsprechende Therapie für den Patienten in Frage kommt1. Scheidet diese wegen eines hohen Komplikationsrisikos, gravierenden Begleiterkrankungen oder der Ablehnung des Patienten zu dieser Maßnahme aus, ist wegen der fehlenden Konsequenz keine anschließende Diagnostik notwendig1.
Eine bioptische Sicherung eines biochemischen Rezidivs nach RPE ist nicht erforderlich1. Sie sollte jedoch bei Patienten nach Strahlentherapie mit der Option einer lokalen Rezidivtherapie angestrebt werden1. Generell gilt, dass bei einem biochemischen Rezidivnachweis nach primärer kurativ intendierter Therapie und lokaler Rezidivtherapieoption zwischen lokalem und systemischem Rezidiv differenziert werden soll1. Zu diesem Zweck sollen
- die PSA -Verdopplungszeit
- die Latenzzeit zur primären kurativ intendierten Therapie und
- der Gleason-Score herangezogen werden1.
Auf eine systemische Progression weist eine kurze PSA -Verdopplungszeit (z. B. <3 Monate) hin, während eine langsame Verdopplungszeit eher mit einem lokalen Rezidiv korreliert1. Auch ein Gleason-Grad >7 macht im Rezidivfall eine systemische Progression wahrscheinlich1.
Die regelmäßige DRU in der Nachsorge sollte auf Patienten mit Tumoren beschränkt werden, die kein PSA sezernieren1.
Bei asymptomatischen Patienten mit biochemischem Rezidiv ist bei einem PSA -Wert <10 ng/ml keine Knochenszintigraphie nötig1. Die vorliegende Literatur zeigt, dass eine ossäre Metastasierung bei PSA <7 ng/ml praktisch nicht vorkommt, bei PSA(Prostataspezifisches Antigen) <10 ng/ml sehr selten ist und erst bei einem PSA(Prostataspezifisches Antigen) -Wert von 20 ng/ml oder mehr die nuklearmedizinische Untersuchung mit hinreichender Wahrscheinlichkeit positive Befunde ergibt1.
Prognose
Bei den tödlich verlaufenden Tumorerkrankungen der Männer steht das Prostatakarzinom mit 10,1 % in Deutschland an dritter Stelle, bei der Betrachtung aller Todesursachen an siebter Stelle1. Pro Jahr sterben in etwa 12.000 Patienten an den Folgen eines Prostatakarzinoms1. Nichts desto trotz hat Prostatakarzinom unbehandelt meist einen langsamen „natürlichen“ Verlauf, so dass nur Männer mit einer Lebenserwartung von mehr als 10-15 Jahren von einer kurativen Therapie profitieren1.
Für die prognostische Evaluation des Prostatakarzinoms sollen folgende Parameter berücksichtigt werden1:
- Gleason-Grading
- TNM -Kategorie
- chirurgische Resektionsränder des Karzinoms
- Lokalisation des Tumors3
Letztgenannter Punkt hat insofern prognostische Bedeutung, da ein Tumor an der Basis der Prostata mit höherer Wahrscheinlichkeit zur Invasion der Samenblase führt und so mit einer schlechteren Prognose verbunden ist3.
Laut Literatur liegt die 10-Jahres-Rate des krankheitsfreien Überlebens bei alleiniger Bestrahlung mit 5-48 % deutlich niedriger als die Angaben bei der Kombinaton von Bestrahlung und endokriner Therapie (57 % und 80 %)1. Die hormonablative Therapie allein zeigt ein krankheitsfreies Überleben nach zehn Jahren von 15-45 %1.Bei alleiniger operativer Therapie liegen die 10-Jahres-krankheitsfreien Überlebensraten bei 0-24 %, bei operativer Therapie kombiniert mit endokriner Therapie bei 36-76 %1.
Sowohl für die RPE als auch für die perkutane Strahlentherapie können in Bezug auf das Überleben folgende Orientierungswerte (Range) angegeben werden1:
- 5 Jahres-biochemisches progressionsfreies Überleben 20-85 %
- 10 Jahres-biochemisches progressionsfreies Überleben 20-51 %
- 10 Jahres-krankheitsspezifisches Überleben 57-91 %
- 10 Jahres-Gesamtüberleben 34-77 %
Briganti et al, 2009 konnten in einer konsekutiven Serie (n=703; mediane Überlebenszeit: 9,5 Jahre) nachweisen, dass das tumorspezifische Überleben bei mehr als zwei befallenen Lymphknoten signifikant schlechter war als bei ≤2 befallenen Lymphknoten1. Dieser cut-off konnte bereits schon 2007 als prognostischer Faktor für das 10-jahrestumorspezifische Überleben dargestellt werden1. In der Serie von Boorjian et al. waren weiterhin ein Gleason-Score von 8-10, positive Schnittränder und die Ploidie des Tumors (diploid versus nichtdiploid) signifikant mit einer schlechteren Prognose assoziiert1.
In einer retrospektiven Kohortenstudie von Kupelian et al konnten hinsichtlich des „biochemisch rezidivfreien“ Überlebens über fünf bzw. sieben Jahre keine signifikanten Unterschiede zwischen den Therapiemodalitäten RPE, Perkutane Strahlentherapie ≥72 Gy, Low-Dose-Rate Brachytherapie und Low-Dose-Rate Brachytherapie + perkutane Strahlentherapie gezeigt werden1. Die Abschätzung des Rezidivrisikos erfolgt mit Hilfe der D´Amico-Klassifikation, dem PSA -Wert und dem Gleason-Score1.
D`Amico Klassifikation7:
| Risiko | Stage | PSA | Gleason Score |
|---|---|---|---|
| Low risk | T2a | ≤10 | ≤6 |
| Intermediate risk | T2b | >10-≥20 | 7 |
| High risk | T2c | >20 | ≥8 |
Weiterführende Literatur
S3-Leitlinie Prostatakarzinom
Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Prostatakarzinom.Diagnostik des Prostatakarzinoms - Konventionelle und molekular- bzw. zellbiologische Methoden
M. Susani, L. Kenner, Z. Culig, Diagnostik des Prostatakarzinoms - Konventionelle und molekular- bzw. zellbiologische Methoden, Pathologe 2009, 30:154–157Immunhistochemische Algorithmen in der Prostatadiagnostik - Was gibt es Neues?
G. Kristiansen, Immunhistochemische Algorithmen in der Prostatadiagnostik - Was gibt es Neues? ; Pathologe 2009, 30:146–153Bildgebende Verfahren bei der Diagnose des Prostatakarzinoms,
M. Seitz, B. Scher, M. Scherr, D. Tilki, B. Schlenker, C. Gratzke, A. Schipf, P. Stanislaus, U. Müller-Lisse, O. Reich, C. Stief, Bildgebende Verfahren bei der Diagnose des Prostatakarzinoms, Urologe 2007, 46:1435–1448Bildgebende Verfahren bei Primärdiagnose und Staging des Prostatakarzinoms
U.G. Mueller-Lisse, K. Miller; Bildgebende Verfahren bei Primärdiagnose und Staging des Prostatakarzinoms; Urologe 2010; 49:190–198Brachytherapie des Prostatakarzinoms
S.H. Stübinger, R. Wilhelm, S. Kaufmann, M. Döring, S. Hautmann, K.P. Jünemann, R. Galalae; Brachytherapie des Prostatakarzinoms; Urologe 2008, 47:284–290„Dangerous liaisons“ im Prostatakarzinom - Klinische und biologische Bedeutung rekurrenter Genfusionen
S. Perner; „Dangerous liaisons“ im Prostatakarzinom - Klinische und biologische Bedeutung rekurrenter Genfusionen; Pathologe 2010; 31:121–125Prostatakarzinom
Hohenfellner M. Prostatakarzinom: ein Update. Urologe 2010 49 Suppl 1:169-71.Früherkennung von Prostatakarzinomen - Ist die Untersuchung des Serum-PSA alleine ausreichend?
C. Börgermann, F. vom Dorp, G. Breuer, S. Kliner, H. Rübben; Früherkennung von Prostatakarzinomen - Ist die Untersuchung des Serum-PSA alleine ausreichend? ; Urologe 2010, 49:1351–1355Histologische Diagnostik an der Prostatastanzbiopsie
J. Köllermann, G. Sauter; Histologische Diagnostik an der Prostatastanzbiopsie; Urologe 2009, 48:305–313Prostatakarzinom
H.-P. Schlemmer; Prostatakarzinom; Radiologe 2008, 48:45–51Differenzialdiagnose des Prostatakarzinoms - Rolle der Mustererkennung und der Immunhistochemie
H. Bonkhoff; Differenzialdiagnose des Prostatakarzinoms - Rolle der Mustererkennung und der Immunhistochemie; Pathologe 2005; 26:405–421
Referenzen
1 M. Wirth et.al.; Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms; Leitlinienprogramm Onkologie der AWMW, Deutschen Krebsgesellschaft e.V. und Deutschen Krebshilfe e.V., Deutsche Gesellschaft für Urologie e. V. (DGU); Version 2.0 – 1. Aktualisierung 2011
2 S. E. Mills, D. Carter, J. K. Greenson, und V. E. Reuter, Sternberg’s Diagnostic Surgical Pathology, Lippincott Williams & Wilkins, Auflage: 4th revised edition
3 M. Susani, L. Kenner, Z. Culig, Diagnostik des Prostatakarzinoms – Konventionelle und molekular- bzw. zellbiologische Methoden, Pathologe 2009, 30:154–157
4 G. Kristiansen, Immunhistochemische Algorithmen in der Prostatadiagnostik – Was gibt es Neues? ; Pathologe 2009, 30:146–153
5 M. Seitz, B. Scher, M. Scherr, D. Tilki, B. Schlenker, C. Gratzke, A. Schipf, P. Stanislaus, U. Müller-Lisse, O. Reich, C. Stief, Bildgebende Verfahren bei der Diagnose des Prostatakarzinoms, Urologe 2007, 46:1435–1448
6 U.G. Mueller-Lisse, K. Miller; Bildgebende Verfahren bei Primärdiagnose und Staging des Prostatakarzinoms; Urologe 2010; 49:190–198
7 S.H. Stübinger, R. Wilhelm, S. Kaufmann, M. Döring, S. Hautmann, K.P. Jünemann, R. Galalae; Brachytherapie des Prostatakarzinoms; Urologe 2008, 47:284–290
8 S. Perner; „Dangerous liaisons“ im Prostatakarzinom – Klinische und biologische Bedeutung rekurrenter Genfusionen; Pathologe 2010; 31:121–125
9 M. Hohenfellner; Prostatakarzinom: ein Update; Urologe 2010; 49:169–171
10 C. Börgermann, F. vom Dorp, G. Breuer, S. Kliner, H. Rübben; Früherkennung von Prostatakarzinomen – Ist die Untersuchung des Serum-PSA alleine ausreichend? ; Urologe 2010, 49:1351–1355
11 J. Köllermann, G. Sauter; Histologische Diagnostik an der Prostatastanzbiopsie; Urologe 2009, 48:305–313
12 H.-P. Schlemmer; Prostatakarzinom; Radiologe 2008, 48:45–51
13 H. Bonkhoff; Differenzialdiagnose des Prostatakarzinoms – Rolle der Mustererkennung und der Immunhistochemie; Pathologe 2005; 26:405–421
14 K. Eichler, S. Hempel, J. Wilby, L. Myers, L. M. Bachmann, J. Kleijnen; Diagnostic Value of Systematic Biopsy Methods in the Investigation of Prostate Cancer: A Systematic Review; The Journal of Urology; Volume 175, Issue 5, May 2006, Pages 1605-1612
15 Böcker, Denk, Heitz, Moch, Pathologie, 4. Auflage 2008; Elsevier GmbH, München
Lehrtexte Spezielle Pathologie

Prostata - weitere Lehrtexte
Keine weiteren Lehrtexte.
Prostata - Kasuistiken
Organpathologie-Atlas
Weiterführende Literatur
- Prostata (19)