Ösophaguskarzinom
Definition
Beim Ösophaguskarzinom handelt es sich um einen malignen Tumor der Speiseröhre. Die Tumoren lassen sich in Plattenepithel- (ca. 50-60%), Adeno- (30-40%)7 und endifferenzierte Karzinome (10%) unterteilen9. In 0,1% der Fälle finden sich Melanome7. Das Ösophaguskarzinom ist mit großem Abstand die häufigste Neubildung im Bereich der Speiseröhre8. (97-98% aller Tumoren dieses Organs)Epidemiologie
Weltweit zählt das Karzinom des Ösophagus zu den zehnthäufigsten Tumorentitäten und zu den dritthäufigsten Tumoren des Gastrointesinaltraktes1. Die Inzidenz ist durch ausgeprägte regionale Unterschiede gekennzeichnet48. Während in manchen Regionen Chinas jährlich bis zu 130 Patienten pro 100 000 Einwohner erkranken, sind es in Europa nur etwa 6 pro 100 000 Einwohner4. Bei den Tumoren des Ösophagus unterscheidet man in erster Linie zwischen Adeno- und Plattenepithelkarzinome, wobei insbesondere die Inzidenz der Adenokarzinome in den letzten 15 Jahren in der westlichen Welt um das Vierfache gestiegen ist34. Die Inzidenz der Plattenepithelkarzinome, die lange Zeit anteilsmäßig dominierten, ist hingegen in den letzten Jahren in den Hochrisikogebieten insgesamt leicht zurückgegangen3. Das mittlere Erkrankungsalter liegt um die 60 Jahre (60% der Patienten gehören dem 6. Und 7. Lebensjahrzehnt an)78. Der Altersgipfel liegt bei den Männern zwischen dem 57. und 67. Lebensjahr, bei den Frauen zwischen dem 54. und 62. Lebensjahr8. Männer sind bis zu fünfmal häufiger betroffen9, das gilt für beide histologische Tumorentitäten5. Patienten die an einem Plattenepithelkarzinom erkranken, sind in der Regel bis zu 10 Jahre jünger als Patienten mit einem Barett-Karzinom25.
Ätiologie
- Hauptrisikofaktoren für Plattenepithelkarzinome: Für ihre Entstehung sind vor allem hochprozentiger Alkohol und Nikotin bedeutsame Risikofaktoren356. Bei Alkoholikern, die mehr als 80 mg Alkohol pro Tag zu sich nehmen, erhöht sich das Risiko, an einem Plattenepithelkarzinom des Ösophagus zu erkranken, um das 18fache6. Bei gleichzeitigem Genuss von 20 mg Tabak pro Tag ist das Risiko sogar um den Faktor 44 erhöht6. Eine weitere wichtige Rolle spielt Untergewicht, Mangelernährung (Geringer Verzehr von Obst und Gemüse4 und daraus resultierend mangelhafte Aufnahme von Vitaminen5 ) und Fehlernährung (Aufnahme von Nitrosaminen, zu scharfe und zu heiße Nahrung6 ).
- Hauptrisikofaktor für Adenokarzinome: für die Entstehung von Adenokarzinomen ist die gastroösophageale Refluxkrankheit3 ausgehend von der Barrett-Schleimhaut über die Metaplasie und Dysplasie zum Karzinom der entscheidende Risikofaktor5, und betrifft 85-95% aller Patienten mit Adenokarzinomen7. Die Dauer der Symptomatik und die Wahrscheinlichkeit für das Auftreten eines Barrett-Ösophagus scheinen hierbei direkt miteinander zu korrelieren4. Weitere entscheidende Risikofaktoren umfassen Übergewicht (Adipositas: BMI >30kg/m²9 ) und männliches Geschlecht4.
- Achalasie: Sie geht mit einer 2-20%tigen Entartungswahrscheinlichkeit einher89. Bevorzugt kommt es dabei zur Entstehung von Plattenepithelkarzinomen6. Zwischen dem Beginn klinischer Symptome und der Karzinomentstehung liegen in etwa 20 Jahre.
- Verätzungsstrikturen: Sie führen nach einer Latenz von vielen Jahren zum Plattenepithelkarzinom und entarten in insg. 2-15% der Fälle9.
- Plummer-Vinson-Syndrom: Dieses seltene Syndrom tritt zumeist bei postmenopausalen Frauen auf und ist durch Eisenmangelanämie, Unterernährung und Dysphagie gekennzeichnet6. Bei etwa 10% der Patientinnen entstehen zusätzlich Plattenepithelkarzinome des Hypopharynx oder des Ösophagus6.
- Virale Infekte (Papillomaviren): In Ösophaguskarzinomen konnte neben dem Stamm HPV-6 vor allem die Stämme HPV-16 und 18 in Tumorgewebe nachgewiesen werden6. Allerdings bestehen Unterschiede in den Nachweisraten, so dass die Bedeutung dieses infektiösen Agens vorerst unklar bleiben muss6. Als entscheidender onkogener Effekt von HPV-16 gilt die Expression der viralen Proteine e6 und e7, die die zelluläre Kontrollwirkung der Gen-Produkte des tp53-Tumorsupressorgens und des Retinoblastomgens rb1 inaktivieren können6.
- Tylosis palmaris et plantaris: Patienten, die diese sehr seltene erbliche Dyskeratose aufweisen, die mit hochgradiger Epithelverdickkung der Hohlhände und Fußsohlen einhergeht, zeigen vermehrt Ösophaguskarzinome8.
Pathogenese
Es ist bekannt, dass einer der ersten Schritte für die Entwicklung des Ösophaguskarzinoms die Transformation des Zylinderepithels zur Zylinderepitheldysplasie für das Plattenepithel-CA bzw. zur Barrett-Mukosa beim Adeno-CA sind5. Weitere Mutationen, die für eine maligne Transformation verantwortlich sind, unterscheiden sich dann jedoch für beide Entitäten5.
Die Inaktivierung des Tumorsuppressorgens p53 spielt eine entscheidende Rolle bei der Entwicklung des Ösophaguskarzinoms5. In Plattenepithelkarzinomen des Ösophagus können derartige Veränderungen in etwa 33-55% der Fälle nachgewiesen werden6. In einem hohen Prozentsatz finden sich dabei Mutationen eines alleliaschen Gens ohne gleichzeitigen Verlust des anderen Allels6. Dies hat entweder den Verlust der Aktivität des tp 53-Proteins (LOF ) oder die Entfaltung onkogener Effekte (GOF ) zur Folge6.
Durch die negative Beeinflussung der Zellzyklusregulation und des „DNA-Mismatch-Repair- Systems“ tragen auch die Gene p15 und p16 zur Tumorprogression beim Ösophaguskarzinom bei5. Eine Inaktivierung von p16 (Verlust eines Allels des Chromosoms 9p21-22; in dieser Region befindet sich das Gen MTS-1, das für das p16-Protein kodiert6) durch Mutation, Deletion und oder Hypermethylierung führt zu einer unkontrollierten Zellproliferation5. Ein Allelverlust des p16-Gens, das die Retinoblastomgenfunktion reguliert, findet sich in 70–90% der Tumoren und kann bereits auch in diploiden Zellpopulationen im Barrett-Ösophagus nachgewiesen werden5. Hypermethylierungen der p16-Promoterregion finden sich dagegen häufig in Barrett-Karzinomen und nehmen im Verlauf der Sequenz zu5.
Weiterhin konnte bei Plattenepithel-CA eine Amplifikation von Cyclin-D1 (Auf Chromosom 11q13 befindet sich das Cyclin-D1 Gen) nachgewiesen werden, durch welche die Tumorzellen einen Wachstumsvorteil erhalten5. In Studien konnte gezeigt werden, dass eine Überexpression von Cyclin-D1- mit einer schlechten Prognose, erhöhten Frequenz von Lymphknotenmetastasen, hohen Proliferationsrate des Tumors und einem schlechten Ansprechen auf Chemotherapie korreliert5.
Veränderungen, die ebenfalls bereits im dysplastischen Epithel und somit früh in der Entwicklung zum Plattenepithelkarzinom des Ösophagus in Erscheinung treten, betreffen Allelverluste (LOH) der chromosomalen Region 3p14.26. Das hier lokalisierte Fragile Histidine Triad-Gen (FHIT-Gen) ist ein Tumorsuppressorgen das besonders empfänglich auf die Einwirkung chemischer Karzinogene reagiert6. Bis zu 80% aller Plattenepithelkarzinome des Ösophagus zeigen einen LOH dieses Genlocus6, wobei schwere Raucher und Alkoholiker häufiger betroffen waren als bei anamnestisch unauffälligen Patienten6.
Bei 40-71% der Dysplasien und invasiven Karzinome des Ösophagus findet sich eine Amplifikation und Überexpression des EGFR6. Zudem werden beide Liganden des Rezeptors, EGF und TGF-α, in den Karzinomzellen überexprimiert6. Studien konnten zeigen, dass das Ausmaß der EGFR Überexpression mit dem Differenzierungsgrad und der Häufigkeit von Lymphknotenmetasen korreliert6. Die Expression der Liganden EGF und TGF-α ist zudem mit der Invasionstiefe und letztlich mit der Prognose der Tumoren assoziiert6.
Makroskopie – Morphologie
- CIS (Carcinoma in situ): Makroskopisch kann das CIS zum einen als erhabene oder flache Epithelverdickung zum anderen als eingesunkene Verdünnung des Schleimhautepithels imponierten und weißlich (Leukoplakie), rötlich (Ertythroplasie) oder unverändert (okkulter Typ) erscheinen8. Das CIS (Carcinoma in situ) tritt in 10-20% solitär und in 80-90% multipel auf8.
- Polypöses Karzinom: Diese Wachstumsform ist mit ca. 60% am häufigsten. Mit zunehmender Größe kommt es an der manchmal auch multilobulär beschaffenen Oberfläche des intraluminal gelegenen Tumors zu Ulzerationen8. Spindelzell- oder Plattenepithelkarzinome mit spindelzelliger Komponente imponieren häufig als große polypös wachsende und gestielte Karzinome ohne Wandinfiltration8.
- Diffus infiltrierendes Karzinom: Dieser Typ findet sich in etwa in 15% der Fälle8. Der Tumor wächst primär intramural und infiltriert weit in die benachbarte oberflächlich intakte Ösophagusschleimhaut8. Zentrale Ulzeration sind meist viel kleiner als der gesamte Tumor, der zu einer zirkulären Stenose der Ösophaguslichtung und zu einer zunehmenden Rigidität der Ösophaguswand führt8.
- Ulzeröses Karzinom: In etwa 25% der Fälle imponiert der Tumor als unregelmäßig begrenztes hämorrhagisches Ulkus mit wallartig erhabenen Rändern8. Das Ausmaß der Obstruktion hängt im Wesentlichen vom Grad des intramuralen Wachstums ab8. Eine Abheilung flacher ulzeröser Defekte der Ösophagusschleimhaut ist keine Garantie dafür, dass es sich um benigne Läsionen handelt8 und sollten deshalb immer biopsiert werden.
- Variköses Karzinom: Unter dieser Bezeichnung sind Tumoren beschrieben, die in ihrem endoskopischen und röntgenologischen Bild Ösophagusvarizen ähneln8.
Lokalisation:
Plattenepithelkarzinome entwickeln sich meist im Bereich des mittleren oder unteren Ösophagus16, Barrett-Karzinome liegen im unteren Drittel des thorakalen Ösophagus110. Die meisten Tumoren sind zum Zeitpunkt der Diagnosestellung tief invasiv und deshalb häufig nicht mehr kurativ zu resezieren6. Die durchschnittliche Größe der Plattenepithelkarzinome liegt bei ca. 6,5cm8. Bei der Größenbeurteilung der Tumore ist nach Formalinfixation zu berücksichtigen, dass das resezierte Ösophaguspräparat erheblich schrumpft (Die Resektionsränder schrumpfen auf 32-39%, wobei die proximalen Resektionsränder stärker schrumpfen8 ). Der Tumor wird hierbei um insgesamt ca. 10% kleiner8.
Mikroskopie
| Präkanzeröse dysplastische Epithelveränderungen | Morphologie |
|---|---|
| Plattenepitheliale Dysplasien und Carcinoma in situ | Sie treten als Vorläuferläsionen von invasiven Karzinomen auf, können aber auch im Randbereich von Tumoren8 angetroffen werden und sind somit Indikatoren für ein entstehendes oder bereits existierendes benachbartes Karzinom6. In 66 bis 95% der Fälle findet sich in unmittelbarer Nachbarschaft bzw. in einiger Entfernung von Karzinomen eine plattenepitheliale Dysplasie bzw. ein CIS8. Je nach Schweregrad zeigt sich eine erhebliche Bandbreite an morphologischen Abnormitäten6. Geringgradige Dysplasien mit nur diskreten nukleären Atypien (Vergrößerung der Zellkerne, Hyperchromasie) und nur minimaler Störung der Architektur und Ausdifferenzierung des Plattenepithels auf der einen Seite, neben Läsionen mit weitgehender oder vollkommener Aufhebung der Schichtung, schweren zytologischen Atypien und lymphozytärer Infiltration mit Lymphfollikeln8 auf der anderen Seite6. Letztere werden als hochgradige Dysplasien oder Synonym als CIS definiert6. Je schwerer die plattenepitheliale Dysplasie, umso häufiger geht sie mit einem CIS einher8. Trotz Vorliegen einer Dysplasie oder eines CIS kann es dennoch äußerst schwierig sein, eine Invasion von Tumorzellen auszuschließen, vor allem dann, wenn sich dysplastisches Epithel entlang der Ausführungsgänge von submukösen Schleimdrüsen in die Tiefe ausbreitet6. Eine beginnende Invasion ist häufig durch die Ausbildung von Papillen gekennzeichnet, die gegen die Lamina propria vorwachsen und etwas größere Zellen mit z.T. deutlicher Keratinisierung enthalten6. Ein charakteristisches Merkmal von invasivem Wachstum ist die Desmoplasie (Bindegewebsvermehrung)6. Allerdings ist gerade in diesem frühen Stadium eine Desmoplasie häufig nicht sicher nachweisbar6. |
| Barrett-Mukosa | Hierunter versteht man den Ersatz des Plattenepithels im unteren Ösophagusdrittel, oberhalb des gastroösophagealen Übergangs durch Zylinderepithel mit Becherzellen10. (Intestinale Metaplasie) Ein Barrett-Ösophagus kann nur bioptisch und somit histologisch gesichert werden und wird in Abhängigkeit seiner Ausdehnung gemessen vom gastroösophagealen Übergang in „Long-segment“- (‡ 3 cm) und „Short-segment“-Barrett-Ösophagus (< 3 cm) unterteilt410. Endoskopisch ist das weiße Plattenepithel des Ösophagus durch eine rötliche Schleimhaut ersetzt, die sich zungenförmig oralwärts ausdehnt10. (Siehe Abb. 536) Histologisch besteht die Barett-Mukosa aus einem Zylinderepithel mit villöser Architektur und eingestreuten intestinalen Becherzellen10. (Siehe Abb. 537) Die Ausreifung des Epithels zur Oberfläche hin ist erhalten, selten kommen andere gastrointestinale Zellelemente wie Paneth-Zellen, neuroendokrine Zellen oder Pankreasepithelien vor10. Histologisch erkennt man die intraepitheliale Neoplasie der Barett Mukosa durch bis an die Oberfläche reichende Zellatypien des Zylinderepithels, eine gesteigerte mitotische Aktivität und die Ausbildung komplexer Foveolararchitekturen (Ausknospungen und Verzweigungen)10. Karzinome der Speiseröhre entwickeln sich somit über leichtgradige („low-grade“) bzw. schwergradige („high-grade“) intraepitheliale Neoplasien (= Dysplasien)4. |
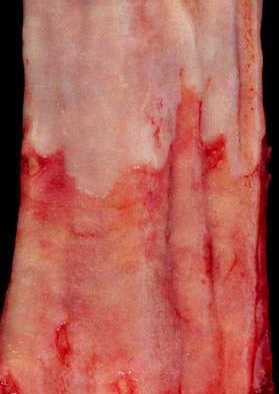
Abb. 536: Intestinale Metaplasie: Ersatz des Plattenepithels (blassrosa, obere Bildhälfte) des unteren Ösophagus durch Zylinderepithel mit Becherzellen (untere Bildhälfte)
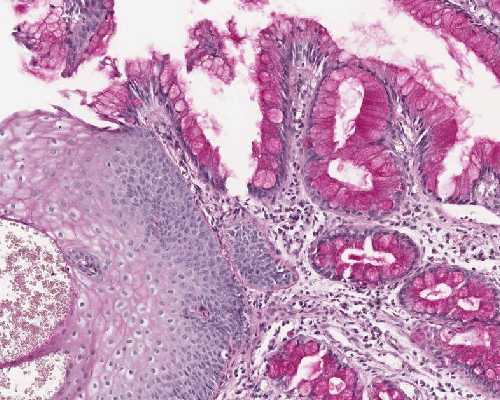
Abb. 562: Nebeneinander reifer Plattenepithelien und intestinalen Oberflächenepithels mit Becherzellen (PAS)
| Tumorentität | Morphologie |
|---|---|
| Plattenepithelkarzinome | Invasive Tumoren zeigen histologisch zum Teil eine große Variabilität6. Viele Tumoren sind gut bis mäßig differenziert. Je nach Differenzierung findet sich eine sehr ausgeprägte Kernpolymorphie, typische epidermoide Charakteristika wie Keratinisierung, Ausbildung von Hornperlen und gut erkennbaren interzellulären Brücken6 und desmoplastischen Stromareaktionen10. Andere Tumoren sind so gering differenziert, dass sie nur schwer als Plattenepithelkarzinome zu klassifizieren sind und bestehen überwiegend aus kleinen bzw. großen „primitiven“ Zellen ohne Differenzierung6. Auch Mischformen kommen vor6. So können neben überwiegend squamös differenzierten Anteilen auch Areale mit glandulärer oder kleinzelliger Differenzierung auftreten6. |
| Adenokarzinome | Sie gehen aus dystopen Magenschleimhautinseln, persistierenden embryonalen Zylinderepithelinseln oder aus Schleimdrüsen der Ösophaguswand hervor, vor allem aber entstehen sie im Verlauf eines Barrett-Syndroms8. Histologisch zeigen sie einen tubulären oder papillären Aufbau7. (Abb. 170) Es finden sich aber auch unregelmäßige invasive Zellformationen, gelegentlich Siegelring-Zell-Infiltrationen oder reichlich extrazelluläre Muzinproduktion7. Fokale plattenepitheliale Anteile, als auch Panethzellen, eine endokrine Differenzierung und in seltenen Fällen auch eine Keimzelldifferenzierung können möglich sein7. Der drüsig differenzierte Tumor lässt sich gut mit der PAS bzw. der Alcianblue-Färbung darstellen7. |
| Adenoid-zystisches Karzinom | Diese Tumorentität ist sehr selten, und entspricht in seiner histologischen Struktur den adenoid-zystischen Speicheldrüsenkarzinomen8. Als Ausgangspunkt werden im Ösophagus in erster Linie submuköse Drüsen und tracheobronchiale Gewebsinseln diskutiert8. |
| Mukoepidermoidkarzinom | Die Tumoren zeigen die histologische und elektronenmikroskopische Struktur der gleichnamigen Speicheldrüsenkarzinome8. Ihr Entstehungsort wird in Ausführungsgängen submuköser schleimbildender Drüsen angenommen8. Sie enthalten gleichermaßen plattenepitheliale als auch drüsige Tumorformationen7. |
| Adenosquamöses Karzinom | Diese Tumore bevorzugen den gastroösophagealen Grenzbereich und sind selten8. |
| Kleinzelliges Karzinom | Diese Tumoren werden auch als Oat-cell Karzinome bezeichnet und sind insg. selten8. Sie zeigen eine schnelle Progression und sind häufig in der unteren Hälfte des Ösophagus lokalisiert7. Der Tumor entspricht histologisch den kleinzellig-anaplastischen Karzinomen der Lunge und entsteht aus neuroendokrinen Zellen, die zwischen den Basalzellen der Ösophagusschleimhaut liegen8. Histologisch finden sich Nester kleiner runder bis ovaler Zellen mit dichten hyperchromatischen Zellkernen (Salz- und Pfefferstruktur des Chromatins) und wenig Zytoplasma7. Rosetten und karzinoid-ähnliche Formationen als auch foklale plattenepitheliale und drüsige Komponenten können in Erscheinung treten7. Ultrastrukturell finden sich neurosekretorische Granula7, einige Tumoren zeigen eine ACTH Produktion8. Das kleinzellige Karzinom des Ösophagus spricht auf die zytostatische Therapie des Oat-cell Karzinoms der Lunge an und sollte nicht operiert werden8. Durch frühzeitige Lymph- und Blutgefäßeinbrüche hat diese Tumorentität eine schlechte Prognose8. Differentialdiagnostisch muss diese Tumorentität vom kleinzelligen anaplastischen Plattenepithelkarzinom wegen großer histologischer Ähnlichkeit abgrenzt werden8. |
| Malignes Melanom | Sie treten mit 0,1% sehr selten im Ösophagus auf und gehen in der Regel mit einer schlechten Prognose einher7. Makroskopisch imponiert der Tumor als pigmentierte polypöse Masse, es können aber auch amelanotische Tumoren vorkommen7. Histologisch variieren epitheloide und spindelige Zellen, die zu Platten oder Nestern zusammengefügt sind7. |
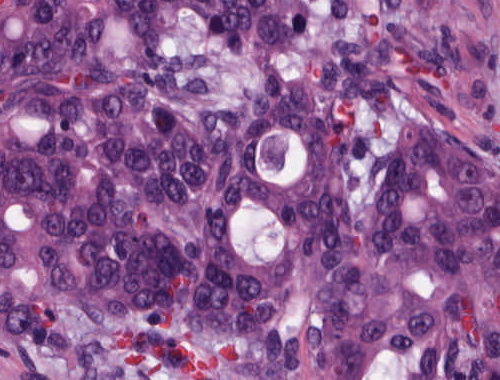
Abb. 170: Barrett-Karzinom des Ösophagus. Erkennbar sind glanduläre Tumorformationen, die Tumorzellen mit verschobener Kern-Plasmarelation und hyperchromatischen Kernen mit z.T. deutlich erkennbaren Nukleoli.
Neben dem bei weitem überwiegenden „klassischen“ Plattenepithelkarzinom gibt es auch seltene Sonderformen6:
| Varianten des Plattenepithelkarzinoms | Morphologie |
|---|---|
| Spindelzellkarzinome | Sie imponieren makroskopisch als polypoid-konfigurierte Formen des Plattenepithelkarzinoms, die aus einer squamös differenzierten und einer sarkomatösen Komponente aufgebaut sind6. In den sarkomatösen Abschnitten kann es u.U. sogar zur Ausdifferenzierung von Knorpel, Knochengewebe oder Muskelgewebe kommen6. Aufgrund ihres endoluminalen Wachstums werden die Tumoren meist frühzeitig diagnostiziert und zeigen deshalb eine verhältnismäßig gute Prognose6. |
| Basaloide Plattenepithelkarzinome | Sie stellen eine hochmaligne Varianten des Plattenepithelkarzinoms dar, in denen monomorphe basaloide Tumorzellen dominieren und nur vereinzelt kleine Tumorabschnitte mit eindeutiger squamöser Differenzierung auftreten6. |
| Verruköse Plattenepithelkarzinome | Sie stellen sehr seltene hochdifferenzierte Plattenepithelkarzinome dar, die aus zytologisch relativ unauffälligen Tumorzellen bestehen und lokal aggressiv wachsen, jedoch nicht metastasieren6. |
Das histopathologische Grading ist einheitlich geregelt3. Die Kriterien für das Grading von Plattenepithelkarzinomen stützen sich hierbei auf das Ausmaß der Verhornung, die Ausbildung von Interzellularbrücken und die Schichtung der Epithelverbände3. Bei Adenokarzinomen stellt die Ausbildung der drüsigen Strukturen das wesentliche Kriterium dar3.
Die Beurteilung der anatomischen Ausbreitung (Staging) dieser Tumoren wird nach der TNM-Klassifikation vorgenommen3.
Tumormorphologie nach neoadjuvanter Therapie
- Typing: Hier finden sich je nach Tumorentität unterschiedliche Effekte auf die malignen Zellen3. Während bei Plattenepithelkarzinomen mitunter eine verstärkte Verhornung anzutreffen ist, findet man bei Adenokarzinomen häufiger eine muzinöse Differenzierung3.
- Grading: Die neoadjuvante Therapie verändert die Tumormorphologie. Es finden sich vermehrt Nekrosen, Fibrosen und zytologische Veränderungen der Epithelzellen, die damit auch die Kriterien auf denen das Grading basiert, beeinflussen3. Infolgedessen ist ein Grading nach neoadjuvanter Therapie nicht sinnvoll anzuwenden nicht zuletzt auch weil es schlecht reproduzierbar ist3.
- Regressionsgrading: Zur Beschreibung des Ausmaßes regressiver Veränderungen, welches das gesamte Spektrum von vollständiger Abwesenheit regressiver Veränderungen (keine Regression) über unterschiedliche Mengen vitalen Tumors bis hin zu nicht mehr nachweisbarem vitalem Tumor (komplette Regression) abdeckt, wird das Tumorregressionsgrading eingesetzt3. Ein national oder international standardisiertes, allgemein akzeptiertes Gradingsystem existiert bislang jedoch nicht, obwohl dieses insbesondere im Hinblick auf die Vergleichbarkeit zahlreicher Studien zur Bedeutung der Tumorregression (Response) für die Prognose von großer Bedeutung wäre3.
Metastasierung
- Lymphogen: Der Eintritt von Tumorzellen in die lymphogene Zirkulation kennzeichnet den Übergang von einem lokalen in ein systemisches Tumorleiden, das in der Mehrzahl der Fälle durch ablative Verfahren alleine nicht mehr Erfolg versprechend therapiert werden kann4. Die Eindringtiefe des Karzinoms in die Ösophagus-Wandung und die Prävalenz von Lymphknotenmetastasen korrelieren direkt miteinander und sind die beiden wichtigsten Prognose beeinflussenden Parameter47. Unterschiede bezüglich der Inzidenz von Lymphknotenmetastasen zwischen Plattenepithel- und Adenokarzinomen sind nur in ganz frühen Tumorstadien zu finden4. So konnten verschiedene Erhebungen zeigen, dass Adenokarzinome mit ausschließlichem Befall der Tunica mucosa (T1a) nur in 1,2% und bei Fortschreiten bis in die Tunica submucosa (T1b) in etwa 20% lymphogen metastasierten4. Bei Plattenepithelkarzinomen muss hingegen schon bei solitärem Befall der Tunica mucosa von einem Lymphknotenbefall in etwa 6,5% und bei Ausdehnung bis in die Tunica submucosa in bis zu 50% der Fälle ausgegangen werden4. Bei T2-Tumoren finden sich in rund 70% der Fälle und unabhängig von der Tumorentität Lymphknotenmetastasen4. Ein weiteres Fortschreiten mit Befall aller Wandschichten bzw. organüberschreitender Progress geht in 80 bzw. 90–100% mit Lymphknotenbefall einher4. Die lymphogene Metastasierung erfolgt im zervikalen Ösophagus über periösophageale, zervikale und supraklavikuläre LK, im oberen thorakalen Ösophagus über periösophageale und mediastinale LK, im unteren thorakalen Ösophagus über periösophageale, mediastinale und perigastrische LK8. (Die LK um den Truncus coeliacus werden bereits als M1 klassifiziert9 )
Die Tumorzellen breiten sich schnell über die Lymphgefäße in beide Richtungen1, bevorzugt jedoch nach kranial und weit über die Grenzen des Tumors aus6. Ab einer Größe von 5 cm haben bzeigen bereits mehr als 90% der Patienten Lymphknotenmetastasen6. - Hämatogen: Die hämatogene Metastasierung erfolgt in der Regel erst spät, zum einen über die V. azygos und V. cava sup. in den Thorax (Lungenmetastasen) zum anderen über die V. gastrica sinistra und V. portae in die Leber9. Daneben kann es aber auch zu einer Infiltration von Knochen, Nebennieren, Nieren und Gehirn kommen1. Da Ösophaguskarzinome zumeist erst in fortgeschrittenen Stadien durch klinische Symptomatik auffallen, liegen bei einem größten Teil der Patienten zum Zeitpunkt der Erstdiagnose bereits Fernmetastasen vor4.
- Per continuitatem: Das Einwachsen in die Umgebung ist aufgrund der fehlenden Serosa schnell möglich18. Am häufigsten infiltriert der Tumor die Trachea, die Bronchien und das Mediastinum8. Hier können neurale Strukturen (N. vagus, N.recurrens, Ganglion cervicale des Grenzstrangs) und seltener Gefäße (Aorta, A. pulmonalis, A.thyreoidea inf.) betroffen sein8. Weiterhin kommt es häufig zu einer Infiltration von Lungen, Pleura und Zwerchfell6, als auch von Schilddrüse, Larynx und Perikard1. Für eine tracheobronchiale Invasion, sprechen u.a. tracheoösophageale bzw. bronchioösophageale Fisteln1.
Klinik
Das Ösophaguskarzinom geht in der Regel ohne Frühsymptome einher9. Das klassische Leitsymptom ist die Dysphagie (Schluckbeschwerden)2 mit einer Häufigkeit von ca. 87%9. Zur Dysphagie kommt es allerdings erst bei einer Lumeneinengung von mehr als 50%9 und fällt vor allem bei trockener Nahrung dem Patienten auf2. Weitere Symptome umfassen Gewichtsabnahme (71%), retrosternale Schmerzen (46%), Regurgitation (30%) und Pseudohypersalivation (Unmöglichkeit den Speichel zu schlucken)9. Heiserkeit, Husten, und Rückenschmerzen zählen zu den seltenen Symptomen9. Ein evtl. tastbarer Tumor, und tastbare zervikale Lymphknotenmetastasen finden sich nur bei weit fortgeschrittenem Tumorwachstum9. Besonders bei kleinzelligen Karzinomen können paraneoplastische Syndrome beobachtet werden8.
Diagnostik
- Anamnese und klinische Untersuchung: U.a. Ausschluss relevanter Nebendiagnosen in Bezug auf die operative Therapie.
- Labor: Tumormarker zur Verlaufskontrolle9. (SCA bei Plattenepithelkarzinomen, CEA bei Adenokarzinomen)
- Ösophago-Gastroskopie und Biopsie: Die Endoskopie kann Frühformen des ösophagealen Karzinoms erfassen und somit zur Prognoseverbesserung entscheidend beitragen5. Da die chronische Refluxkrankheit mit einem erhöhten Erkrankungsrisiko für Adenokarzinome des Ösophagus assoziiert ist, sollten Patienten mit über längere Zeit bestehender klinischer Refluxsymptomatik endoskopisch untersucht werden4. Grundsätzlich ist zu berücksichtigen, dass die Erstendoskopie bei einem Patienten mit Dysphagie der Diagnosefindung dient2. In einem weiteren Schritt ist in Anbetracht der longitudinalen Ausdehnung der Plattenepithelkarzinome endoskopisch nach Schleimhautmetastasen oral oder aboral des Tumors zu suchen2. Weiterhin sollten möglichst auch Zweitkarzinome vor allem im Bereich des Hypopharynx bei Barett-CA aber auch in Magen und Kolon5 endoskopisch ausgeschlossen werden2.
- Endosonografie: Für die Beurteilung der Wandinfiltrationstiefe und die Umgebungsbeziehung ist die Endosonographie die Untersuchung der Wahl1249. So konnten verschiedene Studien Übereinstimmungen des präoperativen, endosonographischen Stagings mit dem pathologisch aufgearbeiteten Resektat bezüglich der Tumoreindringtiefe in 85% zeigen4. Auch hinsichtlich der Diagnose des Lymphknotenstatus wurde eine Sensitivität von 72–89% und eine Spezifität von 75–97% ermittelt4. Vor allem runde LK mit einem homogenen echoarmen zentralen Muster und einer klaren Grenze, die größer als 10mm sind, gelten als suspekt1.
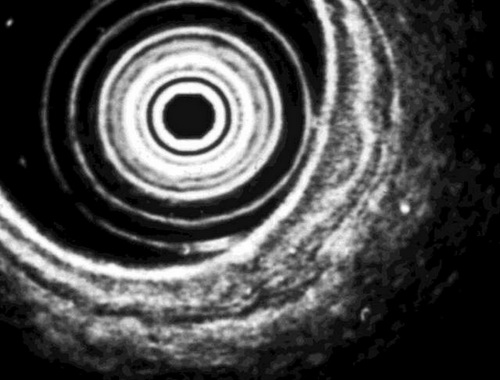
Abb. 538: Endosonographie des Ösophagus: Die Wand des Ösophagus kann mit Hilfe der Endosonografie in Form von fünf alternierenden Schichten unterschiedlicher Echogenität dargestellt werden, so dass genaue präoperative Bestimmung der Tiefe der Tumorinvasion erfolgen kann.
Die erste Schicht ist echoreich und stellt die Schnittstelle zwischen Ballon und oberflächlicher Schleimhaut dar. Die zweite Schicht ist echoarm und zeigt die Lamina propria und muscularis und die dritte Schicht ist wieder echoreich und repräsentiert die Submukosa. Die vierte Schicht ist echoarm und vertritt die muscularis propria und die fünfte Schicht ist wieder echoreich und stellt die Schnittstelle zwischen der Serosa und umgebendem Gewebe dar.
Erkennbar ist in obiger Abbildung eine Verbreiterung der Mukosa-/Submukosaschicht
- CT- Thorax/Abdomen: Mit der CT können v.a. asymmetrische Wandverdickungen (>5mm) erste Hinweise auf ein Tumorwachstum geben1. Sie ist allerdings nicht dazu in der Lage, die Tumoreindringtiefen (T-Stadien) adäquat zu differenzieren14 und dient vielmehr der Fragestellung der Umgebungsbeziehung des Primärtumors2 und dem Ausschluss von Fernmetastasen12. Bezüglich des T-Status kommt der Untersuchung in erster Linie bei der Beurteilung wandüberschreitenden Tumorwachstums (T4) und eventueller Miteinbeziehung benachbarter Strukturen Bedeutung zu [1]4. Die Beurteilung des N-Status ist dadurch erschwert, dass nicht alle vergrößerten Lymphknoten Tumorgewebe enthalten und nicht alle metastatisch betroffenen Lymphknoten vergrößert sind14. Sensitivität und Spezifität werden daher mit 11–77% und 71–95% angegeben4. Im Allgemeinen gilt jedoch, dass thorakale und abdominelle Lymphknoten, die größer als 1cm im Durchmesser und supraklavikuläre Lymphknoten, die > 5mm sind, als vergrößert und damit suspekt zu betrachten sind1.Bei der Erkennung viszeraler Fernmetastasen ist die CT-Untersuchung anderen diagnostischen Verfahren am stärksten überlegen14. So beträgt die Sensitivität in der Detektion hepatischer Absiedlungen beispielsweise 70–80%4.
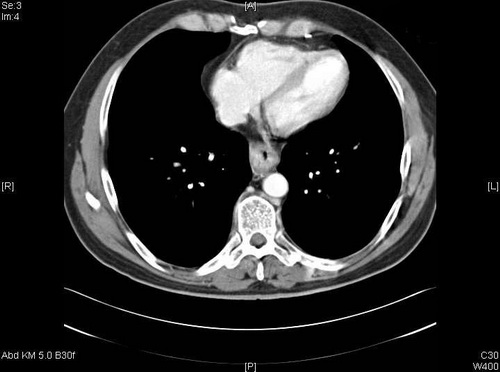
Abb. 539: CT-Thorax: Erkennbar ist eine Verdickung der ösophagealen Wand mit Lumeneinengung
- FDG-PET: Mit der FDG-PET können nicht nur Fernmetastasen erfasst bzw. ausgeschlossen werden, vielmehr lässt auch die Intensität des Tumormetabolismus prognostische Rückschlüsse zu und ermöglicht vor allem bei der Entscheidung zugunsten einer neoadjuvanten Therapie eine frühzeitige Responseevaluation mit entsprechenden therapeutischen Konsequenzen zu2. Während die Sensitivität der Untersuchung in der Detektion von Ösophaguskarzinomen zwischen 78 und 95% liegt, ist auch hier die Bestimmung des T-Status nur unzureichend möglich4. Auch in der Diagnostik von Lymphknotenmetastasen, die in der Nähe des Primärtumors liegen, erreicht die FDG-PET nur eine Sensitivität von 28–51%4. In der Beurteilung weiter entfernt liegender Lymphknotenstationen (oberer Thoraxbereich, zervikal, abdominal) wird hingegen bereits eine höhere Sensitivität (67–82%) erzielt14. Die größte Stärke der Untersuchung liegt jedoch in der genauen Beurteilung der Tumorausdehnung bei Stadium-IV-Patienten4. Hier konnte bereits eine Überlegenheit zur CT-Untersuchung gezeigt werden4. (Sensitivität und Spezifität 74 und 90% [FDG-PET] im Vergleich zu 41 und 83% [CT]) Im Gegensatz zur Endosonographie und CT-Diagnostik ermöglicht die FDG-PET zusätzlich eine Aussage über die Tumor-Stoffwechselaktivität4. Diese Information kann in der Beurteilung des Ansprechens auf Chemo- und Radiotherapien (z. B. nach Induktionstherapie) nützlich werden4. Neuere Untersuchungen konnten für die FDG-PET ferner einen prognostischen Wert demonstrieren4. So zeigten Tumoren mit hoher FDG-Aufnahme eine schlechtere Prognose als solche mit niedriger Aufnahme4.
- Bronchoskopie: Besteht ein Bezug des Tumors zum Tracheobronchialsystem bzw. ist er oral der Trachealbifurkation gelegen, muss auch eine endoskopische Abklärung des Tracheobronchialsystems erfolgen, um einen Tumoreinbruch in dieses System auszuschließen2. Weiterhin hat ein Ausschluss von Zweittumoren in der Lunge bei histologisch differenzierten Karzinomen zu erfolgen5.
- Mediastinoskopie U.a. Nachweis von LK-Metastasen und infiltrierendem Tumorwachstum9.
- Laparoskopie: Beim Barett-CA ist in Anbetracht der meist distalen Lokalisation eine Mitbeteiligung der Bauchhöhle nicht selten, so dass eine diagnostische Laparoskopie beim lokal fortgeschrittenen Barrett-Karzinom durchaus Sinn macht2. In ca. 20% der Fälle ist eine Peritonealkarzinose oder zumindest der Nachweis von freien Tumorzellen in der Peritoneallavage zu erwarten2.
Differentialdiagnosen
- gutartige Ösophagustumoren: Leiomyome, Lipome, Fibrome, Hämangiome, granuläres Neuroblastom (Abrikossoff-Tumor), Papillome, Adenome und Polypen9.
- Hodgkin Lymphom9
- Kardiakarzinom9
- Narbenstenose9
- Achalasie9
- Divertikel9
- Sklerodermie9
Therapie
- Neoadjuvante Therapie: Sie kann als kombinierte Radio-Chemotherapie beim T3/T41 Ösophaguskarzinom mit plattenepithelialer Komponente2 mit dem Ziel zum Einsatz kommen, durch eine Verkleinerung des Tumors eine Resektion zu ermög¬lichen bzw. die Wahrscheinlichkeit einer Resektion im Gesunden (R0) zu er¬höhen3. Bei Barett-Karzinomen ist aufgrund der meist günstigeren Lage ein Tumor-Downsizing nicht unbedingt notwendig, so dass eine alleinige Chemotherapie, die Primarius und Filiae erreichen soll, als ausreichend betrachtet werden kann2. Hat sich dennoch der Tumormetabolismus in der FDG-PET um mehr als 35% zurückgebildet, kann von einer Response ausgegangen werden2. So genannte Responder erhalten dann eine volle Chemotherapie, d. h. zumindest zwei komplette Zyklen, Nonresponder dagegen profitieren davon nicht und sollten möglich rasch operiert werden2.
- Endoskopische Resektion: Prämaligne Veränderungen wie „high-grade“ intraepitheliale Neoplasien, die per definitionem noch nicht lymphogen metastasiert haben, können durch ablative Verfahren kurativ therapiert werden4. Hierfür stehen die endoskopische Mukosektomie, thermische Ablation oder photodynamische Therapie zur Verfügung4. Während im Rahmen von Mukosektomien die veränderte Mukosa abgetragen wird und somit prinzipiell einer histologischen Aufarbeitung zugänglich ist, kommt es bei den anderen beiden Verfahren zur Zerstörung des dysplastischen Gewebes4. Bei der thermischen Ablation kann beispielsweise mittels Übertragung von Hochfrequenzstrom über ionisiertes Argongas ( APC ) das betreffende Gewebe abgetragen werden, während bei der photodynamischen Therapie lichtsensitive Substanzen im Tumorgewebe akkumulieren, um durch Aktivierung mit Laserlicht spezieller Wellenlänge zellzerstörende Sauerstoffradikale freizusetzen4. Alle Verfahren konnten bei leichten und schweren Dysplasien sowie T1a-Tumoren ein rezidivfreies Überleben in 97–100% erzielen4.
- Operative Verfahren: Sie ist bei begrenztem Tumorwachstum (Stadium I und II nach UICC) ohne Fernmetastasen Mittel der Wahl19. Die Ösophagusresektion erfolgt klassischerweise über einen transthorakalen oder transhiatalen Zugangsweg4. Bei der ersten Methode handelt es sich um eine kombinierte Laparotomie und Thorakotomie, die eine ösophagogastrale Anastomose im oberen Brust- („Ivor-Lewis“-Technik) oder Halsbereich („Threefield“-Technik) ermöglicht4. Die transhiatale Operation beinhaltet die Ösophagusresektion vom Abdomen aus mit anschließender Anastomose im Halsbereich und erfolgt ohne Thorakotomie4. Wegen des hohen submukösen Längenwachstums sollte ein kranialer Sicherheitsabstand von 8-10cm (Problem bei hochsitzenden Tumoren) und ein kaudaler Sicherheitsabstand von ca.5cm eingehalten werden1. Aufgrund der frühen lymphogenen Metastasierungsneigung der Ösophaguskarzinome ist weiterhin auch die Lymphadenektomie ein wichtiger Bestandteil der Resektion4. Seit ISDE 1994 werden drei resektable Bereiche unterschieden: „Field-I“ beeinhaltet die abdominellen Lymphknoten im Tumorabflussgebiet, „Field-II“ die thorakalen und „Field-III“ die zervikalen Lymphknoten4. Über das erforderliche Ausmaß der Lymphknotenausräumung besteht noch keine allgemeingültige Einigkeit4.
Folgende Rekonstuktionsmöglichkeiten stehen zur Verfügung: Der Magenhochzug unter Opferung der oberen Magengefäße ist heute die Methode der Wahl9. Weitere Möglichkeiten umfassen ein Koloninterponat (Vorteil: eigene Gefäßversorgung, Nachteil: starkter Foetor) und als ultima ratio das Dünndarminterponat (hinderlich sind hier die Gefäßarkaden)9. Die Rekonstruktion kann im ursprünglichen Bett des Ösophagus, aber auch retrosternal im vorderen Mediastinum erfolgen9. Wichtig ist die spannungsfreie Adaptation der Anastomosen9. - Palliative Therapie: Bei nicht resektablen Tumoren erfolgt eine kombinierte Radio-Chemotherapie (60-63 Gy, 5-FU und Cisplatin)9. Bei Stenosen kann die endoskopische Lasertherapie (kurze Stenosen), Bougierungsbehandlung aber auch die Einlage eines Endotubus (ringverstärkter Tubus (Häring-Tubus) oder eines selbstexpandierenden Metallstents erforderlich werden9. Bei einem nicht beseitigbarem Passagehindernis kann die Anlage einer Magenfistel zur Ernährung (PEG oder Witzel-Fistel) erforderlich werden9.
Prognose
Karzinome des Ösophagus sind trotz vielfältiger medizinischer Bemühungen immer noch mit einer fast unverändert schlechten Prognose assoziiert49. So konnte das durchschnittliche 5-Jahres-Überleben seit den 70er-Jahren im Vergleich zu den späten 90er-Jahren nur um 8 auf 13% angehoben werden4. Die 10-Jahres-Überlebensraten liegen beim Barrett-Karzinom insgesamt bei 40%, beim Plattenepithelkarzinom bei 20%2. Ca. 60% der Patienten sind insgesamt operabel, aber nur 25% können in kurativer Intention(R0-Reskektion) operiert werden9. Der Vergleich zwischen Inzidenz und Mortalität maligner epithelialer Tumoren der Speiseröhre in Europa und den USA zeigt, dass etwa 90 bis 95% der betroffenen Patienten an dieser Krankheit auch versterben4. Hierbei ist von einer durchschnittlichen Überlebenszeit von 9 Monaten ab Diagnosestellung auszugehen9, beim Nachweis von Lymphknotenmetastasen von nur 6 Monaten4. Diese ungünstige Prognose lässt sich in erster Linie durch die relative Symptomarmut in den frühen Krankheitsstadien einerseits und die frühe lymphogene Metastasierung der Ösophaguskarzinome andererseits erklären4. So liegt der Anteil der im Stadium I diagnostizierten Patienten, bei denen noch keine Lymphknotenbeteiligung nachweisbar ist, in Deutschland noch immer unter 10%4.
Prognosefaktoren sind:
- Sitz des Primärtumors: Je höher das Karzinom sitzt, desto schlechter ist die Prognose8.
- Tumorgröße: Je größer die Längenausdehnung und das Tiefenwachstum, umso schlechter ist die Prognose8.
- Wachstumstyp: Das szirrhöse Karzinom hat infolge einer frühzeitigen und irreversiblen Stenose und Tumorkachexie die schlechteste Prognose8. Polypoid wachsende oder gestielte Plattenepithelkarzinome haben eine bessere Prognose als stenosierende und ulzeröse Formen8.
- Anzahl befallener Lymphknoten2: Am wichtigsten für die Prognose ist das Vorhandensein bzw. Fehlen von regionalen LK-Metastasen78.
- Geschlecht und Alter2
- TNM-Stadium2 und Invasionstiefe7
- Lymphangiosis carcinomatosa [2]
- Zeitpunkt der Operation2
- ostoperative Komplikationen2
- R0-Resektion27
- Histologie2
Bei den lokal fortgeschrittenen Tumoren profitieren vor allem die so genannten „Responder“ von einer multimodalen Therapie2. (10-Jahres-Überlebensrate von 45%) Die multimodale Therapie hat damit zu einer deutlichen Verbesserung der Prognose geführt2.
In einem ungewöhnlich hohen Prozentsatz (etwa 10-15%) zeigen die Patienten multiple Primärtumoren und/ oder Malignome in anderen Organen des Kopf-Hals-Bereichs [6].Unabhängig von Stadium und den angewandten Therapiemodalitäten beträgt die 5-Jahres-Überlebensrate der Plattenepithelkarzinome hier lediglich 5-9%6.
Prävention
Eine Vorsorgeuntersuchung gibt es in Deutschland bislang nicht2. Eine Ausnahme bilden lediglich Patienten, bei denen ein Barrett-Ösophagus endoskopisch diagnostiziert worden ist und die dann regelmäßige Kontrollendoskopien wahrnehmen2. Die Effektivität dieser Überwachungsstrategie zeigt sich in einer ständig zunehmenden Rate diagnostizierter Barrett-Frühkarzinome2. Derzeit kommen ca. 40% der neu diagnostizierten Barrett-Karzinome als Frühbefunde in die Klinik2.
Weiterführende Literatur
Multimodality Assessment of Esophageal Cancer: Preoperative Staging and Monitoring of Response to Therapy
Tae Jung Kim, MD; Hyae Young Kim, MD; Kyung Won Lee, MD; Moon Soo Kim, MD; Multimodality Assessment of Esophageal Cancer: Preoperative Staging and Monitoring of Response to Therapy, RadioGraphics 2009; 29:403–421Ösophaguskarzinom
Siewert JR. Ösophaguskarzinom. Der Onkologe. 10.1007/s00761-007-1272-2.Pathologie und neue UICC-Klassifikation des Ösophaguskarzinoms
Wittekind C, Oberschmid B. Pathologie und neue UICC-Klassifikation des Ösophaguskarzinoms. Onkologe. 2010 16:453–461.Ösophaguskarzinome – Diagnostik und Therapie
Baumhoer D, Ramadori G. Ösophaguskarzinome – aktueller Stand der Diagnostik und Therapie. Zeitschrift für Gastroenterologie. 2005 Apr;43(4):399-409.Plattenepithelkarzinom und Adenokarzinom des Ösophagus
Bollschweiler E, Ell C. Plattenepithelkarzinom und Adenokarzinom des Ösophagus. Onkologe. 2004 10:1168–1178.Ätiologie, Molekularbiologie und Pathologie des Plattenepithelkarzinoms des Ösophagus
Offner FA. Ätiologie, Molekularbiologie und Pathologie des Plattenepithelkarzinoms des Ösophagus. Pathologe. 2000 Sep;21(5):349-57.
Referenzen
1 Tae Jung Kim, MD; Hyae Young Kim, MD; Kyung Won Lee, MD; Moon Soo Kim, MD; Multimodality Assessment of Esophageal Cancer: Preoperative Staging and Monitoring of Response to Therapy, RadioGraphics 2009; 29:403–421
2 J.R. Siewert, Ösophaguskarzinom, Onkologe 2007, 13:949–960
3 C. Wittekind, B. Oberschmid, Pathologie und neue UICC-Klassifikation des Ösophaguskarzinoms, Onkologe 2010, 16:453–461
4 D. Baumhoer, G. Ramadori, Ösophaguskarzinome – aktueller Stand der Diagnostik und Therapie, Z Gastroenterol 2005; 43: 399–409
5 E. Bollschweiler, C. Ell, Plattenepithelkarzinom und Adenokarzinom des Ösophagus, Onkologe 2004 • 10:1168–1178
6 F. A. Offner, Ätiologie, Molekularbiologie und Pathologie des Plattenepithelkarzinoms des Ösophagus, Pathologe 2000, 21:349–357
7 S. E. Mills, D. Carter, J. K. Greenson, und V. E. Reuter, Sternberg’s Diagnostic Surgical Pathology, Lippincott Williams & Wilkins, Auflage: 4th revised edition
8 W. Remmele, Pathologie Bd. 3 Leber, Galle, Pankreas, Atemwege, Springer-Verlag Berlin Heidelberg, 2. Auflage 1996
9 M. Müller, Chirurgie für Studium und Praxis 2010/11: Unter Berücksichtigung des Gegenstandskataloges und der mündlichen Examina in den Ärztlichen Prüfungen
10 W. Böcker, Pathologie; Elsevier GmbH, München, 4. Auflage 2008
