13a: Glioblastom (WHO Grad 4)
Morphologie
Makroskopisch sind Glioblastome durch ihre ausgeprägt bunte Schnittfläche, die Folge von Nekrosen (gelbe Areale) und Tumorblutungen (dunkle Areale) gekennzeichnet. Histologisch erkennt man die Ausprägung charakteristischer Malignitätskriterien: ausgeprägte Kern- und Zellpleomorphie, erhöhte Mitose- und Proliferationsrate, strichförmige Nekrosen mit Palisadenstellung von Tumorzellen im Randbereich, mikrovaskuläre Proliferation in Form von glomerulumartigen Gefäßknäueln, weitlumige, evtl. thrombosierte Tumorgefäße. Häufig finden sich Blutungsresiduen.
13a: Glioblastom WHO Grad 4
13b: Riesenzellglioblastom WHO Grad IV
Immunhistologie
Glioblastome exprimieren in der Regel GFAP (saures Gliafaserprotein). GFAP gehört zur Familie der Intermediärfilamentproteine und ist unter diesen das kleinste mit einem Molekulargewicht von etwa 51 kDa. Im zentralen Nervensystem ist GFAP in Astrozyten und Ependymzellen, aber nicht in anderen Gliazellen nachweisbar. GFAP dient in der Neuropathologie als Marker für das Astrozytom, das Ependymom, das Glioblastom und das Oligodendrogliom. Bei Tumoren des peripheren Nervensystems findet sich GFAP im Schwannom und im Neurofibrom.
Genetische und molekulargenetische Befunde
Patienten mit dem Li-Fraumeni Syndrom (Keimbahnmutationen in TP53) erkranken vermehrt an Glioblastomen. Mutationen in folgenden Genen treten häufig in Glioblastomen auf: CDKN2A, EGFR, TP53, PTEN, CDK4 und RB. Die Verteilung dieser Mutationen spricht für die Existenz von Glioblastom-Gruppen, die nur molekulargenetisch voneinander abgrenzbar sind.
Neuropathologie

Bilder zum Präparat
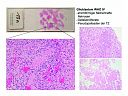
Abb. 51: Glioblastom WHO IV: Strichförmige/ flächenhafte Nekrosen. Gefäßproliferate. Pseudopalisaden der TZ
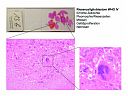
Abb. 52: Riesenzellglioblastom WHO IV: Erhöhte Zelldichte. Pleomorphie/Riesenzellen. Mitosen. Gefäßproliferation. Nekrosen.
Gliome - Weitere Kurspräparate