Malignes Pleuramesotheliom
Definition
Das maligne Pleuramesotheliom ist ein aggressiver solider Tumor der Pleura, der von mesothelialen bzw. submesothelialen Zellen der Pleura ausgeht und ein diffuses Wachstumsmuster aufzeigt.1,3 Weitaus häufiger als MPM sind metastatische Absiedlungen anderer Tumoren oder eine Pleurakarzinose.2 Das MPM ist mit Asbestexposition assoziiert und kommt bei betroffenen Personen ca. 1000x häufiger vor als in der Normalbevölkerung.3 1977 wurden erstmals durch Asbest verursachte Mesotheliome in Deutschland als Berufskrankheit anerkannt und in die Berufskrankheitenverordnung (Listen-Nr. 4105) aufgenommen.2Epidemiologie
Aufgrund der beruflichen Asbestexposition sind Männer weitaus häufiger betroffen als Frauen.2,9 Das Manifestationsalter liegt in Deutschland in der 6. Lebensdekade2,3 Es ist zu erwarten, dass die Inzidenz und Mortalität in den nächsten Jahren stark zunehmen wird.3 Aktuell werden im Deutschen Mesotheliomregister in Bochum jährlich über 500 neue Erkrankungsfälle vermerkt.2 In Westeuropa werden bis zum Jahr 2030 ca. 250000 männliche Mesotheliomtote prognostiziert.3 Derzeit sind ca. 90% im Deutschem Mesotheliomregister erfasste maligne Mesotheliome asbestassoziiert.2
Aufgrund der langen Latenzzeit zwischen Asbestexposition und Beginn der Erkrankung,9 als auch dem steigenden Verbrauch von Asbest bis Mitte der siebziger Jahre wird der Gipfel der diagnostizierten Mesothelomfälle bis zum Jahr 20202 erwartet.3,10 Die Inzidenz der nicht asbestassoziierten MPM beträgt in etwa 1-2:1000000 Einwohner.2,9 Die Latenzzeit zwischen Beginn der Asbestexposition und der Tumormanifestation beträgt im Durchschnitt 30 Jahre,2,10 bei einer Schwankungsbreite von 10-60 Jahren.3,6,9 Die Asbestexposition muss dabei nur ca. 15 Jahre, im Extremfall auch nur wenige Wochen betragen.2,3,6
Ätiologie und Pathogenese
- Die Asbestexposition steht nach wie vor an erster Stelle bei der kausalen Pathogenese maligner Mesotheliome.2 Die zunehmende Verwendung von Asbest nach dem Zweiten Weltkrieg führte im Jahr 1960 zur Beschreibung des ursächlichen Zusammenhangs zwischen Asbestexposition und Entwickung von Mesotheliomen9 Es werden dabei zwei Formen von Asbest unterschieden: Blauasbest (Krokydolith) und Weißasbest (Klinochrysotil).9 Diese Unterscheidung ist insofern von Bedeutung, da der Blauasbest mit einem 10-fach höheren Risiko10 ein MPM zu entwickeln einher geht als der Weißasbest.9 Eine Schwellendosis ist für die Entwicklung des MPM nicht bekannt.2
- Erionit ist ein in bestimmten Regionen der Türkei vorkommender nicht asbestartiger vulkanischer Zeolith, der bei Inhalation ebenfalls mit einem erhöhten Risiko ein MPM zu entwickeln einhergeht.2,9
- Das Simian Virus 40 (SV 40) spielt heute in der Pathogenese der MPM keine wesentliche Rolle mehr.2,9
Makroskopie
Kleinknotige Veränderungen im Bereich der Pleura parietalis kennzeichnen das frühe Stadium eines maligen Pleuramesothelioms.1 Mit zunehmendem Tumorwachstum kommt es zur Fusion der Knoten, später zur Verwachsung der Pleurablätter mit Beteiligung der Pleura visceralis,1 bis im fortgeschrittenen Stadium meist ein mantelförmiges, gleichmäßig die Lunge umschließendes, bevorzugt basal akzentuiertes, weißes, derbes teils pseudozystisches Fremdgewebe zur Darstellung kommt.2 Die Tumorausbreitung erfolgt entlang der Interlobärspalten1 und führt zu einer Obliteration der komplementären Pleurablätter.2 Beim sarkomatoiden Typ kommt es im Gegensatz zum epitheloiden Typ erst sehr spät zur Infiltration in das angrenzende Lungenparenchym.1,2 Im Spätstadium finden sich dann auch vermehrt intrapulmonale Tumorknoten.2
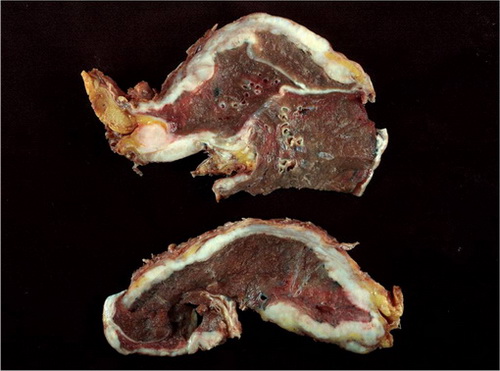
Abb. 446: Schnittfläche des OP-Präparates mit fast vollständige zirkulärer tumoröser Ummauerung der Lunge mit kontinuierlicher Tumorausbreitung entlang der interlobulären Pleura pulmonalis.
Mikroskopie
Histologisch werden drei Haupttypen beim MPM unterschieden: einen epithelialen Typ (40-60% aller MPM), einen sarkomatoiden oder mesenchymalen Typ (20-30% aller MPM) und einen biphasischen Typ (20-30% aller MPM).1 Als vierte Form gibt es noch einen desmoplastischen Typ, der jedoch einen besonders aggressiven Subtyp der sarkomatoiden Variante darstellt.1
- Epitheloider Typ: Sie sind in 90% der Fälle epitheloid differenziert.1 Am häufigsten finden sich tubulo-papilläre oder mikroglanduläre Wachstumsmuster.1 Wesentlich seltener hingegen sind kleinzellige, klarzellige, lymphohistiozytoide oder deziduoide Differenzierungen.1 In den meisten Fällen liegt trotz Dominanz eines bestimmten Wachstumsmusters oft eine Kombination verschiedener Differenzierungen vor.1 Die meisten epitheloid differenzierten Pleuramesotheliome präsentieren ein monotones zytologisches Bild und vermitteln so einen relativ gut differenzierten Eindruck.1 Ein Grading, welches eine Korrelation zwischen zytomorphologischen Merkmalen und der Prognose aufzeigt, existiert nicht.1
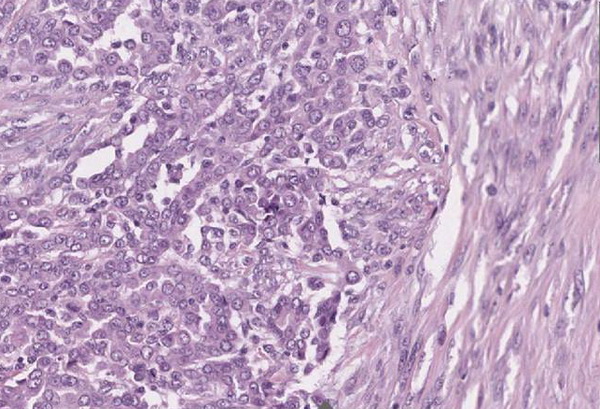
Abb. 445: Drüsenähnliche Tumorformationen umgeben von einem faserreichen Stroma
- Sarkomatoider Typ: Um die Diagnose eines sarkomatoiden Pleuramesothelioms stellen zu dürfen, müssen mindestens 90% des Tumors eine sarkomatoiden Differenzierung aufzeigen.1 Die Tumoren bestehen aus spindelförmigen Zellen, die eine faszikuläre oder ungeordnete Ausrichtung aufweisen können.1 Dabei ist eine herdförmig an andere Sarkome (z. B. Osteosarkome oder Chrondrosarkome) erinnernde Differenzierung möglich.1
- Biphasischer Typ: Biphasische maligne Pleuramesotheliome sind Tumoren die sowohl epitheloide als auch sarkomatoide Muster aufweisen. Jede Kombination der unterschiedlichen Muster ist möglich, und sollte wenigstens 10% des Tumors ausmachen, um die Bezeichnung “biphasisch” zu erhalten.1,2
Immunhistochemie
Zu den Antikörpern welche Mesotheliomzellen markieren, gehören Mesothelin, Calretinin (v.a. epitheloide MPM1 ),2 Thombomodulin und HBME-1.3,9 Ein positiver Nachweis von Zytokeratin 5/6 (v.a. sarkomatoide MPM1 )2 und Vimentin2 bei fehlendem Nachweis von CEA ist immunhistochemisch wegweisend für ein MPM.3,6 Darüber hinaus kann der beim MPM fehlende Nachweis der monoklonalen Antikörper Leu-M1 (CD15) und Ber-EP4 zur Differentialdiagnose gegenüber dem Adenokarzinom herangezogen werden.3,6
Wichige immunhistochemische Kriterien um ein Mesotheliom von einem Adeno-CA zu unterscheiden beinhalten:
- Positive Färbung für saure Mucopolysaccharide
- Fehlen von CEA und Leu-M1 Antigen (beides sind Marker, die bevorzugt bei Adenokarzinomen exprimiert werden)
- starke Färbung von Keratinen, vor allem perinukleär
Zytologie
Die zytologische Untersuchung gewonnener Exsudate kann in bis zu 50% positive Ergebnisse bringen.3,6 Die Differenzierung gegenüber einer Pleurakarzinose bei einem Adenokarzinom oder reaktiv veränderten Mesotheliomzellen kann sich jedoch als schwierig herausstellen.1,3 Sarkomatoid differenzierte MPM lassen sich in der Zytologie nicht diagnostizieren.1 Der immunhistochemische Nachweis von p53 gilt als wichtiger Hinweis für Malignität,3 der Nachweis von EMA (epithelial membrane antigene) als ein Hinweis für ein MPM.9 Zur differentialdiagnostischen Abgrenzung zwischen mesothelialer Herkunft und epithelialen Zellen einer Pleurakarzinose können ergänzende immunzytochemische Untersuchungen hinzugezogen werden.1,6
Frühe neoplastische Läsionen der Pleura
- reaktive Mesothelhyperplasie: Einschichtige, kubische und vergrößerte Mesothelzellen sind charakteristisch für die reaktive Mesothelhyperplasie.1,5Immunhistochemisch exprimieren die Zellen Panzytokeratin (Ck MNF 116), Calretinin sowie Ck 5/6.5 Eine epitheliale Membranantigen Positivität liegt hingegen nicht vor.5 Die reaktive Mesothelhyperplasie kann sich folgenlos zurückbilden.1
- Mesotheliale Inklusionen: Sie sind häufig Folge chronisch rezidivierender Pleuritiden und zeigen eine oberflächenparallele Ausrichtung der Zellen ohne Verzweigung, ohne Atypien und ohne gesteigerte Proliferationsaktivität.1,5 Immunhistochemisch reagieren die Zellen wie jene der reaktiven Mesothelhyperplasie.5 Sie können vor allem in kleinen Biopsien ein infiltratives Wachstum imitieren, und sind dadurch zum Teil differentialdiagnostisch schwer abzugrenzen.1,5
- Atypische Mesothelproliferationen: Dies sind Läsionen, die mit nukleären Atypien und/oder lockerer Mehrschichtigkeit des Mesothels einhergehen.1 Eine Stromaentwicklung unterbleibt.1,5 Vereinzelt kann eine EMA-Positivität vorliegen, diese ist allerdings nicht so stark ausgeprägt wie beim malignen Mesotheliom, und betrifft meist nur wenige Zellen.5
- Mesothelioma in situ: Mehrschichtigkeit mit zellulären Atypien, eine gesteigerte Proliferationsaktivität, sowie einzelne atypische Mitosen kennzeichnen das Mesothelioma in situ.1,5 Die Zellen sind EMA-Positiv.5 In der Nachbarschaft liegt häufig bereits eine Invasion vor.1,5
- Frühmesotheliome: Sie zeigen ein infiltratives Wachstum, sind aber dennoch auf die Pleura parietalis begrenzt und entsprechen damit dem Stadium pT1 der TNM-Klassifikation.1,5 Flach invasive sind von gemischt exophytisch / invasiven Formen zu unterscheiden.1 Die Diagnose des Frühmesothelioms ist erst mit Hilfe der Bildgebung, oder anhand größerer Resektate zu stellen.1
Staging
Das Staging der MPM richtet sich nach der TNM Klassifikation.1,8 Die Entwicklung des TNM Systems beruht auf der Kategorisierung prognostisch identischer Patientenkollektive, und trägt damit zur Entwicklung neuer therapeutischer Optionen bei.8 Das Stagingsystem beurteilt die Bestimmung des lokalen Tumorausmaßes, des Lymphknotenbefalls und einer möglichen Fernmetastasierung.8 Die genannten Faktoren stehen nachweislich mit der Gesamtüberlebenszeit des MPM in Verbindung.8
Klinik
Da das klinische Bild anfänglich recht unspezifisch ist, vergehen zwischen dem Auftreten der ersten Symptome, und der Diagnosefindung oft 3-6 Monate.4 Die häufigsten Symptome bei einem malignen Pleuramesotheliom umfassen therapierefraktäre bzw. rezidivierende Pleuraergüsse (30% der Patienten9 ), (Belastungs-) Dyspnoe (bei 90% der Patienten4 ) und dumpfe schlecht lokalisierte Thoraxschmerzen auf der betroffenen Seite, die sich beim Auftreten eines Pleuraergusses nicht bessern.2,3 Müdigkeit, Abgeschlagenheit und Gewichtsverlust treten in bis zu 15% der Fälle auf.3 B-Symptomatik, obere Einflussstauung,9 Dysphagie, Heiserkeit9 und Hornersyndrom finden sich vor allem in fortgeschrittenen Stadien.3,4 Ein trockener Reizhusten ist selten.3
Anamnese und körperliche Untersuchung
Von großer Bedeutung zur Diagnosefindung ist die Berufsanamnese, und hier vor allem der Nachweis einer stattgehabten Asbestexposition.3,6,9 Bei der körperlichen Untersuchung findet sich oft vermindertes Atemgeräusch4 vor allem dann, wenn ein Erguss besteht.3 Palpaple Tumormassen,3 eine Asymmetrie des Thorax, eingeschränkte oder aufgehobene Atemexkursionen in der betroffenen Thoraxhälfte und eine supraklavikuläre Lymphknotenvergrößerung4 sind neben einer schmerzbedingten Schonhaltung im fortgeschrittenen Stadium mögliche Untersuchungsbefunde.3,4 Seltenere Erstmanifestationen umfassen eine Perikardtamponade (Infiltration des Peri-/Myokards4 ) und ein Aszites (Tumorpenetration des Zwerchfells mit Erreichen des Peritoneums4 ).3,9 Paraneoplastische Syndrome sind eher ungewöhnlich und umfassen u.U. eine hämolytische Anämie, eine Hypercalciämie und eine Hypoglykämie.
Diagnostik
- Labor: Mögliche Serummarker für die Diagnostik des MPM umfassen Osteopontin, (ein Glykoprotein; erhöhte Werte korrelieren gut mit der Tumorprogression, Invasion und Metastasierung) Mesothelin (ein membrangebundenes Glykoprotein, zeigt eine erhöhte Expression in MPM)und MPF (Megakaryocyte Potantiating Factor, besonders geeignet für das Therapiemonitoring).9,10 Häufig finden sich im Labor erhöhte Thrombozyten und Leukozyten, sowie ein Anstieg der LDH und der alkalischen Phosphatase.3,6 Es ist bekannt, dass die Erhöhung dieser Laborparameter mit einer schlechteren Prognose einhergehen.3
- Tumormarker: Spezifische Tumormarker im Serum, die zur Diagnosefindung beitragen, gibt es beim MPM leider nicht.3 Während das CEA nahezu regelhaft in niedriger Konzentration im Serum gefunden wird, liegt TPS (tissue polypeptide specific antigen) und CYFRA 21-1 in erhöhter Konzentration vor.3,6 Es sei darauf hingewiesen, dass sowohl CEA als auch CYFRA 21-1 eine höhere Sensitivität in pathologischen Präparaten als im Serum zeigen.3,6
- Sonografie: Da bei ca. 80% der Patienten im Rahmen der Erstvorstellung ein Pleuraerguss vorliegt,6 und schon der Nachweis kleinster Ergüsse (<200 ml) möglich ist, die dem konventionellen Röntgen gerne entgehen, findet die Pleurasonografie in der Diagnostik eine breite Anwendung.3 Da sich in der Sonografie MPM gerne wie ein Erguss darstellen, kann zur differentialdiagnostischen Unterscheidung der Doppler eingesetzt werden.7 Weiterhin lassen sich eine Tumorausdehnung und Invasion benachbarter Strukturen (Zwerchfell, Abdomen) sonografisch gut darstellen.3,6
- Röntgen-Thorax: Im konventionellen Röntgen können neben einem Erguss eine diffuse oder noduläre Pleuraverdickung7 sowie eine Schrumpfung des Hemithorax zur Darstellung kommen.3,6 Oft liegt ein kompletter hemithorakaler und zirkumferenter Pleurabefall vor.7 In seltenen Fällen kann das MPM als Rundherd zur Darstellung kommen, und so einem peripheren BC ähneln.7
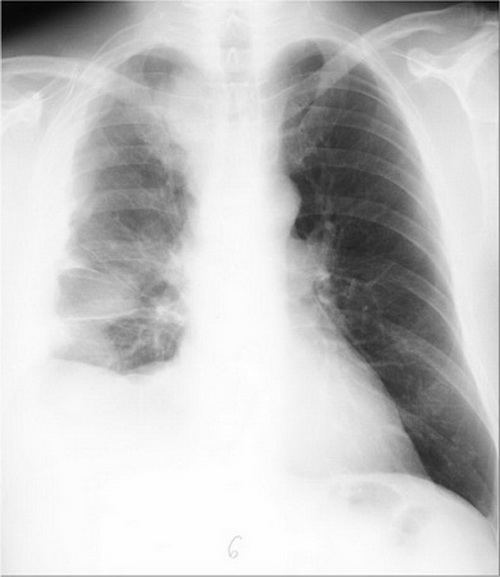
Abb. 355: Röntgen Thorax; an der lateralen Thoraxwand von der Pleurakuppel bis in den Randwinkel des rechten Hemithorax reichende 1-2 cm breite Pleuraverdickung. En face getroffen erzeugen die Pleuraverdickungen flaue rundliche Fleckschatten über allen Lungenfeldern. Lateraler Randwinkel verschattet, Mediastinalkontur rechts durch rundliche Verschattungen deformiert und aufgeweitet.
- CT: Die CT spielt im Rahmen der Diagnostik und der Stadieneinteilung eine wichtige Rolle,3,6,8 und ist das zu Zeit sensitivste nicht invasive Verfahren.4 Eine häufige radiologische Veränderung ist eine noduläre pleurale Verdickung, die bevorzugt die basalen Thoraxabschnitte betrifft.3 Weitere Kriterien die für eine Malignität sprechen, umfassen ein einseitiger Pleuraerguss und die Verdickung der interlobären Fissuren.8 Mit zunehmendem Tumorwachstum entsteht später das typische, die Lunge ummauernde, Bild mit Schrumpfung des betroffenen Hemithorax, ispsilateraler Medialstinalverlagerung, verengten Interkostalräumen und Vorwölbung des ipsilateralen Zwerchfells.3,8 Eine Infiltration der Brustwand, der Lunge sowie ein Befall des Perikards, der mediastinalen Lymphknoten (50% der Fälle) und der kontralateralen Lunge lassen sich gut mit der CT darstellen, und sind im Rahmen des Staging unerlässlich.3,6,8 Kriterien für das Einwachsen des Tumors in die Brustwand umfassen Knochendestruktionen, Verschiebung der Rippen und Infiltration der Interkostalmuskeln.8 In seltenen Fällen lassen sich ein direkter Einbruch in Gefäße oder mediastinaler Organe darstellen.8 Darüber hinaus können Pleuraplaques besser als mit der konventionellen Röntgenaufnahme nachgewiesen werden.3,6
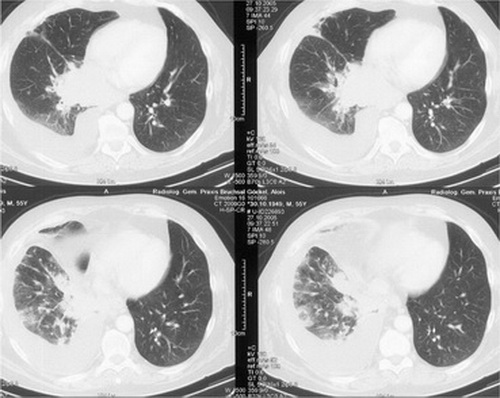
Abb. 352: CT-Thorax (Weichteilfenster), gleiche Raumforderung wie im Knochenfenster. Der Ösophagus kann nicht sicher von Tumorgewebe abgegrenzt werden. Weiterhin finden sich rechtsseitig in der oberen Thoraxapertur und mediastinal Lymphknotenmetastasen.
- MRT: Bei unklaren CT-Befunden kann mit Hilfe der MRT die Tumorausdehnung und damit eine mögliche Infiltration der brustwandnahen Strukturen sowie des Zwerchfells beurteilt werden.8 Die Tumoren präsentieren sich in der T1-Wichtung iso- bis leicht hyperintens, in der T2-Wichtung mäßig hyperintens und zeigen eine verstärkte Kontrastmittelaufnahme bei Gabe von Gadolinium.8
- Echokardiografie: Sie ermöglicht die zuverlässige Darstellung einer Myokard- oder Perikardinfiltration.4
- PET: Sie spielt im Rahmen des präoperativen Stagings,8 als auch postoperativ zum Ausschluss verbliebener Tumormassen, und in der Rezidivdiagnostik eine wichtige Rolle.3 Durch den erhöhten Glucosestoffwechsel in Tumorzellen eignet sie sich vor allem in der Darstellung extrathorakaler und mediastinaler Lymphknotenmetasten8 und hat so eine hohe Sensitivität im Tumornachweis.7 Daneben spricht ein erhöhter FDG-Uptake für eine signifikant kürzere Überlebenszeit.8
- Bronchoskopie: Sie dient dem Ausschluss eines primären Bronchialkarzinoms, da das metastasierende Adenokarzinom die wichtigste Differentialdiagnose darstellt.4,6
- Pleurapunktion: Bei 50% der Patienten ist das gewonnene Pleurapunktat serös oder hämorrhagisch.3,4,6 Laborchemische Analysen erlauben allerdings keinen eindeutigen Rückschluss auf die Genese.3 Eine Erhöhung des CEA im Erguss ist nur selten der Fall.6
- Pleurabiopsie: Sie ist CT- oder ultraschallgesteuert möglich, ihre diagnostische Ausbeute ist allerdings begrenzt, oft ist das gewonnene Material für eine umfassende Diagnostik nicht ausreichend.3,4
- Thorakoskopie: Die diagnostische Ausbeute liegt hier zwischen 90-95%. Ein Vorteil besteht darin, dass die Biopsieentnahme direkt unter Sicht erfolgt und gezielt suspekte Herde biopsiert werden können.3,4,6,9
- Mediastioskopie: Sie hat ihren Stellenwert im Rahmen des Staging. In bis zu 50% finden sich trotz unauffälligem CT ipsilaterale tumorbefallene Lymphknoten. (N2)3,6
Differentialdiagnose
- Pleurametastasen: Diese treten vor allem bei Karzinomen der Lunge, der Mamma, des Magens, des Ovars, der Niere, des Pankreas2 und der Schilddrüse auf.2,3,6
- Pleurakarzinose1,3,4,6
- Periphere Bronchialkarzinome3,4
- Benigne Asbestpleuritis: Diese geht oft mit benignen Pleuraergüssen einher.3,6
- Asbest-assoziierte Pleuraplaques4
- Posttuberkulöse Schwielen4
- pleurale Mesotheleinschlüsse: Differenzialdiagnostisch ist das epitheloide Pleuramesotheliom in frühen Stadien von reaktiven Veränderungen, z. B. von pleuralen Mesotheleinschlüssen im Rahmen einer chronischen Pleuritis abzugrenzen.1
Therapie
Die Operation stellt die einzig mögliche kurative Therapie dar.4 Im Stadium pT1 kann eine parietale oder die kombiniert parietale-viszerale Pleurektomie unter Belassen der Lunge in Kombination mit hilärer und mediastinaler Lymphadenektomie ausreichend sein.4
In etwas fortgeschrittenen Stadien ist dagegen die P3D-Operation, bei der die betroffene
P leura, die P ulmo, das P erikard und das D iaphragma en bloc reseziert werden, die einzige Möglichkeit auf Kuration.4,10,11
Ein weiteres operatives Verfahren umfasst die zytoreduktive Operation (Pleurektomie/Dekortikation (P/D)), bei der der Tumor in der Regel nicht in Sano reseziert wird.9,11 Die Sterblichkeitsrate bei diesem Verfahren liegt unter 5% und ist damit niedriger als bei der P3D-Operation. (Sterblichkeitsrate von 3,4-8%11 )9
Als kleinster palliativer Eingriff kann eine videothorakoskopische Talkumpleurodese versucht werden.4,9,11 Patienten im Endstadium der Erkrankung profitieren gelegentlich von einer dauerhaften Ergussableitung über eine Drainage.4,9,11
Da weder eine alleinige Chemotherapie noch eine alleinige Radiotherapie oder die alleinige OP das Überleben signifikant bessern, und es trotz aggressiver lokaler therapeutischer Maßnahmen bekannt ist, dass ein frühes Lokalrezidiv fast die Regel ist, kommt in spezialisierten Zentren immer mehr ein multimodales Therapiekonzept zur Anwendung.4
Als Chemotherapeutika findet vor allem die Kombinationstherapie aus Cisplatin und Permetrexed in der First Line Therapie Anwendung.9,10 Die Kombination der beiden Chemotherapeutika erhöht neben der Lebensqualität auch die Überlebensrate.10 Eine weitere bevorzugte Kombination umfasst Doxorubcin und platinbasierte Chemotherapeutika, in den letzen Jahren auch Gemcitabine.10 Aber auch Anthracycline und Anthracenedione, Aklylantien, Vinkaalkaloide, Antimetabolite und Taxane werden in der Therapie des MPM eingesetzt.10 Ein Standard für eine Second Line Therapie existiert derzeit nicht.10 In einigen Studien werden jedoch Vinkaalkaloide mit ermutigten Ergebnissen empfohlen.10
Die Chemotherapie kann auch intrapleural verabreicht werden,10 wobei deren Effektivität aufgrund der Studienlage derzeit noch unklar ist.11
Die Strahlentherapie erfolgt als Hemithorax- (54Gy11 ) und/oder Mediastinalbestrahlung,4 und dient vorwiegend der lokalen Tumorkontrolle.9 Bei intraoperativ verbliebenen Tumormassen oder infiltrierten Lymphknoten kann zusätzlich eine Boost-Dosis von 14Gy verabreicht werden.4 Die palliative Bestrahlung findet bei der oberen Einflussstauung, der Dyspnoe und in der Schmerzbekämpfung Anwendung.9
Als neue Verfahren werden neben einer Gentherapie, eine fotodynamische Therapie und die Immuntherapie in klinischen Studien getestet.6 Der therapeutsche Wert der VEGF-Hemmung durch MoAbs und Small Molecule TKI ist derzeit Gegenstand von klinischen Studien.10 Gleiches gilt für den EGFR-Pathway.10
Prognose
Die mittlere Überlebensdauer wird mit ca. 4-18 Monaten angegeben.3,4Ursache für die schlechte Prognose ist neben einer relativen Resistenz gegenüber Strahlen und Chemotherapeutika auch die heute noch häufig zu spät gestellte Diagnose.3 Die meisten Patienten mit einem MPM versterben an respiratorischer Insuffizienz.9 Eine frühzeitige Diagnostik, sowie das Vorliegen eines epithelialen Tumortyps, eine geringe Tumormasse, ein freier Pleuraspalt, Beschränkung des Tumors auf eine Thoraxhöhle, Alter <50, weibliches Geschlecht, tumorfreie Resektionsränder und tumorfreie extrapleurale Lymphknoten können die Prognose der Patienten verbessern, und ein medianes Überleben von 51 Monaten sichern.3,4
Weiterführende Literatur
Pathologie der primären Pleuratumoren
Junker K, Krismann M. Pathologie der primären Pleuratumoren. Zentralbl Chirurgie 2008; 133(3): 222-226.Diagnostik und Stadieneinteilung des malignen Pleuramesothelioms
Sohrab S, Konietzko N. Diagnostik und Stadieneinteilung des malignen Pleuramesothelioms. Pneumologie. 2002 Jun;56(6):382-7.Malignes Mesotheliom (engl.)
Moore AJ, Parker RJ, Wiggins J. Malignant mesothelioma. Orphanet J Rare Dis. 2008 Dec 19;3:34
Referenzen
1 K. Junker, M. Krismann, Pathologie der Primären Pleuratumoren; Zentralbl Chir 2008; 133: 222-226 Georg Thieme Verlag
2 M. Krismann, K.M. Müller; Malignes Mesotheliom der Pleura, des Perikards und des Peritoneums; Chirurg 2000; 71: 877-886
3 S.Sohrab, N.Konietzko, Diagnostik und Stadieneinteilung des malignen Pleuramesothelioms, Pneumologie 2002; 56: 382-387; Georg Thieme Verlag Stuttgart-New York
4 H. Dienemann, C. Trainer, Mesotheliom der Pleura und des Peritoneums-Diagnostische und therapeutische Folgerungen; Chirurg 2000; 71: 887-893
5 M. Krismann et al., Praktische Differentialdiagnose präneoplastischer Veränderungen der Pleura und früher mesothelialer Neoplasien; Pathologe 2006; 27:99-105, Springer Medizin Verlag
6 S. Sohrab et al., Das maligne Pleuramesotheliom, Dt Ärztebl 2000; 97: A3257-3262 (Heft 48)
7 R. C. Bittner, Bildgebende Diagnostik bei Pleuraerkrankungen, Pneumologe 2004; 58:238-254
8 Z. J. Wang, MD et al.; Malignant Pleural Mesothelioma: Evaluation with CT, MR Imaging, and PET; RadioGraphics 2004; 24:105-119
9 A. J. Moore, R. J. Parker, and J. Wiggins; Malignant mesothelioma; Orphanet Journal of Rare Diseases 2008; 3:34
10 D. A. Vorobiof, K. Mafafo; Malignant Pleural Mesothelioma: Medical Treatment Update; Clinical Lung Cancer, Vol. 10, No.2, 112-117, 2009
11 A. S. Tsao, R. Mehran, J.A. Roth, Neoadjuvant and Intrapleural Therapies for Malignant Pleural Mesothelioma; Clinical Lung Cancer, Vol. 10, No.1, 36-41, 2009
Lehrtexte Spezielle Pathologie

<< Respirationstrakt - Tumor >>
Respirationstrakt - Tumor - weitere Lehrtexte
Respirationstrakt - Tumor - Kasuistiken
Organpathologie-Atlas
Weiterführende Literatur