Kolorektales Adenom
Definition
Kolorektale Adenome sind gutartige drüsenbildende Tumoren der Dickdarm- oder Rektumschleimhaut. Die klinische Bedeutung ist deren Eigenschaft als unmittelbarer Vorläufer des kolorektalen Adenokarzinoms.
Klassifikation
Zu den kolorektalen Adenomen gehören die klassischen Adenome und die in den letzten Jahren hinzugekommenen serratierten Läsionen. Sowohl klassische Adenome als auch serratierte Läsionen sind wesentlich häufiger im Kolon und Rektum als im Dünndarm. Die konventionellen Adenome und die serratierten Läsionen werden nach ihrem histologischem Wachstumstyp wie folgt eingeteilt (WHO 2010)1:
- (Klassisches) Adenom
- Tubuläres Adenom
- Villöses Adenom
- Tubulovillöses Adenom
- Serratierte Läsionen
- Hyperplastischer Polyp
- Sessiles serratiertes Adenom (SSA)
- Traditionelles serratiertes Adenom (TSA)
Bei den klassischen Adenome erfolgt zusätzlich eine Unterteilung nach dem Grad der intraepithelialen Neoplasie in Adenome mit niedrig- und hochgradiger intraepithelialer Neoplasie1.
Klassische kolorektale Adenome
Die häufigste Form des kolorektalen Adenoms ist das tubuläre Adenom mit seinem Aufbau aus verzweigten Tubuli, die in die Lamina propria eingebettet sind. Tubuläre Adenome sind im Allgemeinen gestielt, können aber auch flach sein. Derartige flache Adenome sind im Magen häufiger als im Dickdarm zu finden. Das villöse Adenom besteht vorwiegend aus fingerförmigen (zottenartigen) noeplastischen Ausstülpungen der Lamina propria mit neoplastischem Oberflächenepithel. Das villöse Adenom des Kolorektum ist ein solches flaches (sessiles) Adenom, selten ist kann es auch gestielt auftreten. Die Flächenausdehnung eines villösen Adenom kann mehrere Zentimeter betragen. Die gemischte Form, das tubulovillöse Adenom, ist aufgebaut sowohl aus tubulären, als auch aus villösen Strukturen, wobei letztere mehr als 20% ausmachen. Zwischen den einzelnen Adenomtypen bestehen also fließende Übergänge.
Entstehung: In den Krypten des Darmlumens ist die zelluläre Proliferation auf den Kryptenboden beschränkt. Die Zellen wandern dann nach oben und verlieren ihre Teilungsfähigkeit, an der Kryptenspitze werden in das Darmlumen abgeschilfert. Liegt jedoch eine Mutation im APC-Gen vor, bleibt die Teilungsaktivität auch bei den nach oben wandernden Zellen erhalten2. Dadurch entstehen kleine Sprossen, die durch weitere Verzweigungen zu klassischen Adenomen (tubulär oder villös) auswachsen können.
Größe: Im Allgemeinen korreliert die Größe des Adenoms mit dem histologischen Typ. Die mittlere Größe eines Adenome beträgt 0,65 cm bzw. 1,05 cm bzw. 1,72 cm Durchmesser für das tubuläre bzw. tubulovillöse bzw villöse Adenom2. Das tubuläre Adenom ist in 90% unter 1 cm groß, dagegen nur 7% der tubulovillösen und 2% der villösen Adenome2. 20-30% der villösen Adenome sind größer als 3 cm2, sie erstrecken sich oft flächenhaft und können ganzen Zirkumferenz der Darmschleimhaut betreffen. Ihre Größe ist insofern von prognostischer Bedeutung, als diese direkt mit dem Potential des Malignitätsrisikos korreliert (Adenom-Karzinom-Sequenz).
Malignitätsrisiko und Größe des Adenoms10:
| Größe | % mit Adenokarzinom |
|---|---|
| ≤5 mm | praktisch 0% |
| 6-15 mm | 2% |
| 16-25 mm | 19% |
| 26-35 mm | 43% |
| >35 mm | 76% |
Makroskopie: Makroskopisch lassen sich Adenome in gestielt, sessile oder flach einteilen. Dabei sind die tubulären Adenome meist gestielt, können jedoch auch breitbasig der Mucosa aufsitzen. Tubuläre Adenome sind in der Regel sphärisch, und haben eine relativ glatte Oberfläche. Das Adenom imponiert rötlich oder dunkler als die umgebende Schleimhaut. Villöse Adenome hingegen haben eine zottige Oberfläche2.
Histologie: Das Wachstumsmuster bestimmt, ob ein Adenom als tubulär, tubulovillös oder villös eingestuft wird. Alle Adenome zeigen eine Verbreiterung des adenomatösen Epithels, welches beim tubulären Adenom mit Drüsenformationen bzw. Tubulusbildung einhergeht. Diese Kanälchen sind voneinander durch normale Lamina propria getrennt. Im villösen Adenom besteht das gesamte Wachstumsmuster aus fingerförmigen Zotten, die senkrecht von der muscularis mucosae an der äußeren Spitze des Adenoms abgehen. Ein histologisches Beispiel eines villösen Adenoms finden sich in der Rosai Collection. Um entweder von einem tubulären oder einem villösen Adenom sprechen zu können, müssen mindestens 75% bis 80% des Adenoms entweder ausschließlich tubulär oder villös aufgebaut sein.
In Adenomen jeder Art sind die Epithelzellen vergrößert, länglich und weisen hyperchromatische Kerne auf welche palisadenartig angeordnet sein können. Innerhalb des gesamten Adenoms ist die Mitosezahl erhöht und die Muzinbildung der neoplastischen Epithelien ist vermindert. Selten kann man in einem Adenom auch einzelne Panethzellen oder enterochromaffine Zellen, gelegentlich auch Plattenepithelmetaplasien finden. Das neoplastische Epithel der Adenome zeigt unterschiedliche Differenzierungsgrade (Atypien) und die Assoziation dieser zellulären Atypien mit strukturellen Anomalien (der Tubulus- bzw. Zottenbildung) wird als Dysplasie bezeichnet. Die WHO klassifiziert die Dysplasie in high- und low-grade-Dysplasien (bzw. intraepitheliale Neoplasie geringen und hohen Grades). Am häufigsten weist das klassische Adenom low-grade-Dysplasien auf. In der high-grade-Dysplasie zeigen die Krypten unregelmäßige intraglanduläre Verzweigungen und stärkergradige zytologische Atypien mit vergrößerten, hyperchromatischen oder vesikulären Kernen mit prominenten Nukleoli. Mitosen sind bei der der high-grade-Dysplasie häufig, Nekrosen können auftreten. Die Inzidenz einer Dysplasie schweren Grades im einem Adenom beträgt 12,3%2.
Lokalisation: Shinya und Wolff fanden aufgrund einer großen kolonoskopischen Untersuchungsreihe folgende Verteilung der Lokalisation klassischer Adenome3:
- Rektum 5%
- Sigma 45%
- Colon descendens 26%
- Colon transversum 10%
- Colon ascendens 14%
Das Lokalisationsmuster scheint altersabhängig zu sein: Vor dem 55.-60. Lebensjahr dominieren die linksseitig (distal), danach die rechtsseitig (proximal) lokalisierten Adenome2.
Flache Adenome
Sie sind insofern von Relevanz, da gerade diese Läsionen auch bei geringer Größe bereits high-grade-Dysplasien beinhalten können. Damit gelten sie als Vorstufen kleiner maligner Läsionen. Die meisten Studien über flache Adenome stammen aus Japan, ein Befund der darauf hindeutet, dass diese aggressiven Adenome in der westlichen Gesellschaft eher selten zu sein scheinen9. Allerdings konnten koloskopische Screening-Studien aus westlichen Bevölkerungen, welche die Methode der Chromoendoskopie mit Vergrößerung verwendeten, eine Prävalenz von 22% bis 23% für flache Adenome nachweisen9. Studien aus England zeigten, dass 36% aller Adenome ein flaches Wachstum haben, während 63% polypoid und nur 0,6% eingesunken wuchsen9. In prospektiven Screening-Studien aus Japan betrug die Inzidenz von flachen Adenomen ca. 25%9.
Makroskopisch sind diese Läsionen flach oder imponieren als leicht erhabene Plaques, die oft eine zentrale Vertiefung aufweisen, und so leicht während der Koloskopie übersehen werden können, sie sind meist weniger als 1 cm groß9. Die endoskopischen Kriterien für flache Adenome umfassen eine mukosale Erhöhung mit einer flachen oder abgerundeten Oberfläche und einer Höhe von weniger als der halbe Durchmesser der Läsion, die nicht über das typische Erscheinungsbild eines hyperplastischen Polypen hinaus geht9. Die meisten flachen Adenome sind kleiner als 2 mm in der Höhe. Histologisch fehlt ihnen ein polypoides oder exophytisches Wachstumsmuster, und sie erscheinen plaqueähnlich. In vertikaler Ausdehnung sind diese Läsionen nie größer als die doppelte Dicke des angrenzenden neoplastischen Epithels9. Typischerweise handelt es sich um tubuläre Adenome, wobei das dysplastischem Epithel meist auf die luminale Oberfläche der Krypten begrenzt ist9. Die adenomatöse Transformation kann sich aber auch in der gesamten Dicke der Krypte entwickeln, meist ist sie aber auf die Mitte der Läsion beschränkt9. Die Diagnose eines flachen Adenoms sollte histologisch nur gestellt werden, wenn auch das charakteristische endoskopische Erscheinungsbild vorliegt. In flachen Adenomen ist die Inzidenz hochgradiger Dysplasien im Bereich von 10% bis 41% anzusiedeln9 und ist damit weitaus höher als jene von ca 4% bei den klassischen Adenomen.
Adenome mit Pseudoinvasion
Der Begriff der Pseudoinvasion beschreibt eine histologische Situation, in der das Epithel des Polypen in die Submukosa verlagert ist und so ein invasives Tumorwachstum vortäuscht9. Bei der Pseudoinvasion ist das in die Submukosa verlagerte Epithel von der Lamina propria umgeben. Dieser Befund ist wichtig bei der histologischen Differenzierung zwischen einer Pseudoinvasion und einem invasiven Karzinom9. Die displazierten Drüsen zeigen histologisch ein normales Epithel oder adenomatöse Veränderungen bis hin zu hochgradigen Dysplasien und können zystisch dilatiert sein9. Die Submukosa enthält oft frische Blutungen und /oder Hämosiderinablagerungen9, auch dies ein wichtiges histologisches Kriterien. Im Gegensatz dazu findet sich bei invasiven Tumoren eine Infiltration der malignen epithelialen Drüsen in die Submukosa mit begleitender desmoplastischer Reaktion9. Es ist wichtig für den Pathologen diese Situation richtig einzuschätzen, um eine falsche Diagnose einer Tumorerkrankung und ihre Folgen (Operation, Chemotherapie) zu vermeiden. Die Häufigkeit der Pseudoinvasion variiert zwischen 2,5% bis 3,5% bezogen auf alle Adenome9, dabei sind Männer sind dabei dreimal häufiger betroffen als Frauen.
Serratierte Läsionen
Serratierte Läsionen werden unterteilt in hyperplastische Polypen, sessile serratierte Adenome, gemischte Polypen (mit Angabe des IEN-Grades) und traditionelle serratierte Adenome (mit Angabe des IEN-Grades):
- Hyperplastischer Polyp: Hyperplastische Polypen sind eher im linken Hemikolon anzutreffen, Sie sind zumeist leicht über das Schleimhautniveau erhaben und üblicherweise kleiner als 5mm. Histologisch findet sich eine eine Serratierung in der oberen Hälfte bzw. im oberen Drittel, die Krypten sind elongiert, die Kerne klein und basalständig; zytologische oder architektonische Dysplasien sind nicht nachweisbar7.
- Traditionelles serratiertes Adenom: Auch die serratierten Polypen finden sich eher im linken Hemikolon, meist mit polypöses Wachstum, seltener flach erhaben. Die dysplastische Epithelveränderungen entsprechen einer intraepithelialen Neoplasie. Weiterhin ist eine diffuse Zytoplasmaeosinophilie, intraepitheliale Mikroazini bzw. so genannte „ectopic crypt formations“ und eine ausgeprägte Serratierung zu erkennen7.
- Sessiles serratiertes Adenom (SSA): Hierbei handelt es sich um nichtpolypoide Veränderungen, die typischerweise größer als 5 mm messen und rechtskolisch lokalisiert sind. Die histomorphologischen Charakteristika des SSA beinhalten zum einen Hyperserratierung und zum anderen eine Dilatation der Krypten mit Reduktion des Stromas bzw. Verschiebung des Epithel-Stroma-Verhältnisses durch Rücken-an-Rücken-Lagerung dilatierter Krypten. Die Lamina muscularis mucosae erscheint häufig ausgedünnt, zudem können invertierte Krypten unterhalb der Lamina muscularis mucosae vorkommen (so genannte Pseudoinvasion s.u.). Weitere Merkmale umfassen reife Becherzellen an der Kryptenbasis, Verschiebung der Proliferationszone ins mittlere Kryptendrittel und der Nachweis von gering vergrößerten vesikulären Zellkernen mit Nukleolen7.
Bei den serratierten Adenomen und hyperplastischen Polypen liegt im Unterschied zu den klassischen Adenomen die Pathologie im Kryptenboden4. Bei den hyperplastischen Polypen ist im Wesentlichen die Apoptose herunterreguliert, so dass die nach oben wandernden Zellen länger leben; dadurch resultiert ein Aufstau des Kryptenepithels, aus derer die so genannte Serratierung entsteht4. Ursächlich hierfür ist die Herabregulation des Apoptose-Rezeptors Fas in diesen Zellen. Bei den hyperplastischen Polypen ist die Proliferationszone der Krypten hingegen nicht verlängert4.
Fangen die Krypten aufgrund einer Verlängerung der Proliferationszonen an nach unten zu wachsen und sich zu verzweigen, spricht man von serratierten Adenomen. Auffällig ist hier vor allem eine vermehrte Muzin-Bildung. Die Polypen fallen in der Endoskopie häufig durch ein von Gallensäuren gelb gefärbtes Häubchen auf4.
Findet sich ausschließlich eine Apoptosehemmung ausgehend von der Proliferationszone (keine vermehrte Zellteilung, aber längeres Leben der Zellen), hat der vorliegende hyperplastische Polyp nach derzeitigem Kenntnisstand praktisch kein Entartungspotenzial15. Ist hingegen die Zellproliferation in der Krypte betroffen, können diese Zellteilungen zu weiteren genetischen Veränderungen führen4. Aus diesem Grund gilt für die serratierten Adenome ein erhöhtes Karzinomrisiko4. Da in beiden Fällen die Pathologie in der Krypte liegt, bezeichnet man diese Situation auch als Bottom-up-Neoplasie4.
Adenom-Karzinom-Sequenz
Adenome sind von klinischer Bedeutung, weil sie Präkanzerosen darstellen. Im Kolon und Rektum sind sie recht häufig, im Dünndarm hingegen wesentlich seltener. Zu den Häufigkeiten und Malignitätsrisiko kolorektaler Polypen siehe nachfolgende Tabelle10.
| Polypenart | Häufigkeit | davon, mit Ca |
|---|---|---|
| Adenome | 55 % | |
|
28 % | 10 % |
|
4 % | 56 % |
|
22 % | 29 % |
| Hyperplastischer Polyp | 35% | praktisch nicht |
| Traditionelle serratierte Adenome | 8% | geschätzt < 5 % |
| Sessile serratierte Adenome | 2 % | geschätzt < 5 % |
Als Adenom-Karzinom-Sequenz bezeichnet man den pathogenetischen Zusammenhang zwischen dem kolorektalen Adenome als Vorläufer (präkanzeröser Läsion) des kolorektalen Karzinoms. Die Adenom-Karzinom-Sequenz gilt aufgrund folgender Befunde als belegt:
- Karzinome und Adenome finden sich nebeneinander überzufällig häufig in gleichen Darmabschnitten. Patienten mit primär synchronen Mehrfachkarzinomen haben in 75% der Fälle Adenome2.
- Karzinome und Adenome zeigen in etwa die gleiche topografische Verteilung1.
- Der Übergang eines Adenoms in ein Karzinom lässt sich gelegentlich noch daran erkennen, dass (invasive) Karzinome Reste benigner Adenome enthalten, bzw. räumlich unmittelbar an Adenome angrenzen2.
- Die Relation Karzinom/Adenom nimmt von ca. 1:260 im 3. Lebensjahrzehnt auf 1:40 nach der 7. Dekade zu2.
- Das Durchschnittsalter der Adenomträger ist etwa 10 Jahre jünger als das der Karzinompatienten2.
- Es finden sich auf molekulargenetischer Ebene vergleichbare Befunde zwischen Adenomträgern und Karzinompatienten1. (ras-Mutation, chromosomale Deletionen)
- Die Adenom-Karzinom-Sequenz ist tierexperimentell belegbar2.
Der Begriff invasives Adenokarzinom setzt dabei voraus der Tumor bereits die Muscularis mucosae durchbrochen hat und in die Submukosa infiltriert1. Die Unterscheidung zwischen invasivem Tumorwachstum und hochgradiger Dysplasie ist wichtig, da beim invasiven Tumor bereits das biologische Potential zur Metastasierung vorliegt, was bei der Dysplasie noch nicht der Fall ist.
Das Risiko der malignen Entartung eines Adenoms wird somit durch folgende Faktoren beeinflusst1:
- Adenomtyp: Die Tendenz der Adenome zur malignen Entartung nimmt vom tubuären über das tubulovbillöse bis hin zum villösen Adenom zu1. Der Befund eines inzidentiellen Adenokarzinoms in einem kolorektalen Adenom betrifft das tubuläre Adenom in 2% bis 3%, das tubulovillöse Adenome in 6% bis 8% und das villöse Adenome in 10% bis 18%2.
- Dysplasiegrad: Die Häufigkeit eines inzidentiellen Adenokarzinoms in einem kolorektalen Adenom beträgt bei einem tubulären Adenom mit schwerer Dysplasie ca. 5%2, und ist damit doppelt so hoch wie bei tubulären Adenomen per se.
- Adenomgröße: Adenome < 1 cm Durchmesser zeigen nur ganz selten (0,2%) bereits eine Entartung im Sinne eines frühinvasives Karzinoms; zwischen 1 und 2 cm steigt jedoch die Karzinominzidenz auf 1-6% und bei Adenomen >2 cm Durchmesser auf 3-16%2. Polypen, deren Durchmesser 1 cm überschreitet, sollten daher in jedem Fall endoskopisch oder operativ entfernt werden.
- Wuchsform: Gestielte Adenome entarten später als sessil wachsende Adenome1.
Jeder endoskopisch nachweisbare Polyp wird als potentiell neoplastisch bzw. als potentiell maligne betrachtet und sollte aus diesen Gründen vollständig entfernt werden2. Nur eine vollständige Polypektomie erlaubt eine klinisch relevante histologische Diagnose. Anteilige Biopsiepräparate einer polypoiden Läsion sind für eine genaue histologische Diagnose und zur Dignitätsbeurteilung ungeeignet.
1 Bosman FT, Carneiro F, Hruban RH et al. WHO-Classification for Tumours of the Digestive System. Lyon: IARC-Press; 2010
2 W. Remmele, Pathologie Bd. 2 Verdauungstrakt, Springer-Verlag Berlin Heidelberg, 2. Auflage 1996
3 H. Shinya, & W.I. Wolff (1979): Morphology, anatomic distribution and cancer potential of colonic polyps. Annals of surgery, 190(6), 679–683.
4 E. Holinski-Feder, M. Morak: Hyperplastische Polypen, sessile serratierte Adenome, konventionelle Adenome: Molekulare Pathways und deren klinische Relevanz. J Gastroenterol Hepatol Erkr. 8, 18–27, 2010
5 Schmiegel, W., Reinacher-Schick, A., Arnold, D., Graeven, U., Heinemann, V., Porschen, R., Riemann, J., et al: S3-Leitlinie „Kolorektales Karzinom” – Aktualisierung 2008. Zeitschrift für Gastroenterologie, 46, 799–840, 2008
6 S. E. Mills, D. Carter, J. K. Greenson, und V. E. Reuter, Sternberg’s Diagnostic Surgical Pathology, Lippincott Williams & Wilkins, Auflage: 4th revised edition
7 G.B. Baretton, F. Autschbach, S. Baldus, H. Bläker, G. Faller, H.K. Koch, C. Langner, J. Lüttges, M. Neid, P. Schirmacher, A. Tannapfe, M. Vieth, D.E. Aust; Histopathologische Diagnostik und Differenzialdiagnostik serratierter Polypen im Kolorektum. Ergebnisse einer Konsensuskonferenz der AG „Gastroenterologische Pathologie der DGP“; Pathologe 2011; 32:76–82
8 Vieth, M., & Langer, C. (K)Eine Verwirrung um serratierte Kolonpolypen. J Gastroenterol Hepatol Erkr 8, 7–12, 2010
9 S. E. Mills, D. Carter, J. K. Greenson, und V. E. Reuter, Sternberg’s Diagnostic Surgical Pathology, Lippincott Williams & Wilkins, Auflage: 4th revised edition
10 Nusko G, Mansmann U, Partzsch U, Altendorf-Hofmann A, Groitl H, Wittekind C, Ell C, Hahn EG. Invasive carcinoma in colorectal adenomas: multivariate analysis of patient and adenoma characteristics. Endoscopy, 1997 29: 626-31.
Weiterführende Literatur
S3-Leitlinie Kolorektales Karzinom
Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Kolorektales Karzinom.Morphology, anatomic distribution and cancer potential of colonic polyps
Shinya H, Wolff WI: Morphology, anatomic distribution and cancer potential of colonic polyps. Ann Surg. 190: 679-83, 1979
Lehrtexte Spezielle Pathologie

Bilder
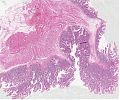
Abb. 654: Lupenvergrößerung eines kolorektalen villösen Adenoms (aus: Rosai Collection, Sem. 581).
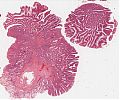
Abb. 655: Lupenvergrößerung eines tubulovillösen Adenoms (aus: Atlas der Organpathologie).
Kolon und Rektum - weitere Lehrtexte
Kolon und Rektum - Kasuistiken
Organpathologie-Atlas
Weiterführende Literatur
- Kolon und Rektum (34)